 |
Виды и характеристики жидкого топлива. (химический состав, характеристики топочных мазутов). Мазутохранилища отопительных котельных.
|
|
|
|
К жидкому топливу относятся продукты переработки нефти. Сырую нефть как топливо не используют. Низшая теплота сгорания нефти мало меняется в зависимости от ее состава и составляет 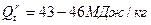
Кислород, азот и сера в нефти находятся в составе высокомолекулярных органических соединений. Природная нефть содержит не более 0,3% минеральных примесей свыше 2% воды. Температура кипения фракций нефти 30-600°С. Нефтепродукты являются синтетическим топливом. Методы получения нефтепродуктов:
· Метод термической разгонки. При этом нефть разделяют на узкие фракции по температуре кипения без разрушения молекулярной структуры фракции.
· Метод термического крекинга. При этом происходит глубокая переработка углеводородов нети с разрушением молекулярных связей и образованием новых соединений с меньшей молекулярной массой.
В зависимости от температуры переработки нефти, нефтепродукты делят на фракции:
Бензиновые t=200-225°С;
Керосиновые t=140-300°С;
Дизельные t=190-350°С;
Соляровые t=300-400°С;
Мазутные t>350°С.
Бензиновые, керосиновые и соляровые фракции являются светлыми нефтепродуктами. Их называют дистиллятным топливом. Из дистиллятных фракций получают топливо печное бытовое (ТПБ). На крупных ТЭС и отопительных котельных в котлах сжигают мазут, на малых отопительных котельных – ТПБ.
Физические свойства жидкого топлива характеризуются:
· Относительной плотностью 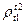 ;
;
· Вязкостью:
1. условной ВУ
2. динамической μ (Па·с);
· Температурой застывания,°С.
Относительной плотностью называют отношение плотности нефтепродукта при температуре 20°С к плотности дистиллированной воды при температуре 4°С.
Условная вязкость – отношение времени, необходимое для непрерывного истечения 200 см3 нефтепродукта при определенной температуре, ко времени истечения 200 см3 дистиллированной воды при температуре 20 °С.
|
|
|
Температура вспышки – температура, при которой топливо будучи нагрето выделяет достаточное количество паров, чтобы смесь этих паров с окружающим воздухом могла вспыхнуть при поднесенном к ней пламени.
Температура застывания – температура, при которой нефтепродукт застывает настолько, что при наклонении пробирки с ним под углом 45° его уровень остается неподвижным в течении 1 минуты.
Мазуты, используемые для производства тепловой энергии в котлах делят на топочные и флотские.
| Показатель | Флотский | Топочный | ||||
| Ф5 | Ф12 | 40В со зн. кач-ва | 100В со зн. кач-ва | |||
| Условная вязкость | ||||||
| При t=50°C | - | - | - | - | ||
| При t=80°C | - | - | ||||
| Температура вспышки не ниже | ||||||
| Массовая доля воды, % | 0,3 | 0,3 | 0,3 | 1,5 | 0,3 | 1,5 |
| Температура застывания не выше | -5 | -8 |
| Низшая теплота сгорания в пересчете на сухое топливо, МДж/кг | 41,45 | 41,45 | 40,6 | 40,6 | 40,53 | 40,53 |
Топочные мазуты по содержанию в них серы делятся на три группы:
· Малосернистые 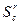 <0,5%;
<0,5%;
· Сернистые 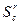 =0,5-2%;
=0,5-2%;
· Высокосернистые 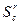 >2%;
>2%;
Зольность мазутов Ad не превышает 0,1-0,3%, увеличиваясь с повышением его вязкости. В золе содержится 3-10 % Fe2O3 и до 29% V2O5. Вода в мазуте 0,5-5% и выше в зависимости от технологии его разогрева в процессе доставки. Разогревают мазут паром.
Плотность мазута – 0,98 – 1,05 кг/м3. относительная теплота сгорания зависит от влажности и составляет 39-42 МДж/кг.
Дизельное топливо имеет низшую теплоту сгорания 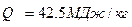 .
.
Выпускается две марки дизельного топлива: ДТ и ДМ.
Марка ДТ: вязкость при t=50°С - 5° УВ;
Температура вспышки более 65°С
Температура застывания менее 5°С.
Марка ДТ: вязкость при t=50°С - 20° УВ;
Температура вспышки более 85°С
Температура застывания менее -10°С.
|
|
|
7. Горение органического топлива (принцип Ле-Шателье, схема развития цепной реакции H2+O2).
Горением называется быстрый процесс экзотермического окисления горючего вещества, сопровождающееся выделением значительного количества тепловой энергии.
Основой процесса горения является химическая реакция между окисляемым горючим веществом и окислителем – кислород или активные его соединения. В результате реакции образуются окислы.
Горючее вещество:
- органическое топливо;
- металлы;
- углеводородные соединения.
Окислители:
- кислород;
- воздух (N2 – 79%, О2 – 21%);
- перекись водорода Н2О2;
- азотная кислота HNO3.
Процесс горения происходит на молекулярном уровне. Отличием горения от родственного ему процесса окисления является:
1. высокая температура
2. быстротечность во времени
3. неизотермичность и переменность концентраций компонентов по мере их взаимодействия.
4. изменение структуры и формы реагирования во времени.
Таким образом, горение – это процесс, протекающий всегда при непрерывном подводе горючего и окислителя в зоне горения и отводе газообразных продуктов из нее.
В основе процесса горения лежат химические реакции горючего с окислителем:
Первичные экзотермические химические реакции полного горения:
С+О2↔СО2+408,8 кДж/кмоль
2Н2+О2↔2Н2О+241,6 кДж/кмоль
СН4+2О2↔СО2+2Н2О+830,4 кДж/кмоль
Первичные эндотермические реакции полного горения:
С+2Н2О↔СО2+2Н2-75,2 кДж/кмоль
Первичные экзотермические химические реакции неполного горения:
2С+О2↔2СО+246,4 кДж/кмоль
СН4+0,5О2↔СО+2Н2+36,4 кДж/кмоль
Первичные эндотермические реакции неполного горения:
С+Н2О↔СО+Н2-118,8 кДж/кмоль
Вторичные реакции полного и неполного горения:
СО+0,5О2↔СО2+285,6 кДж/кмоль
С+Н2О↔СО2+Н2+43,5 кДж/кмоль
СО2+С↔2СО-162,4 кДж/кмоль
Эти реакции обратимы и подчинены принципу Ле-Шателье:
Если на систему, находящуюся в химическом равновесии воздействовать извне, то в ней возникнут самопроизвольные процессы, стремящиеся ослабить это воздействие.
Температура, при которой топливо начинает гореть называется температурой воспламенения топлива.
Торф - 250°С;
Дрова – 300°С;
Каменный уголь – 350°С;
Бурый уголь – 400°С;
Антрацит – 500°С;
Жидкое топливо – 500-600°С;
|
|
|
Газ - 600°С.
Процессы горения в топке котельного агрегата бывают гомогенные и гетерогенные.
Гомогенный – процесс горения, происходящий в однородной по агрегатному состоянию среде (природный газ + воздух, пары жидкого топлива + воздух).
Гетерогенное – горение, при котором горюче вещество и окислитель находятся в различных агрегатных состояниях (горение твердого топлива).
 а) б)
а) б)
1. Область диффузии окислителя и продуктов горения
2. Поверхность реагирования раздела фаз
3. Твердое горючее
4. Жидкость
5. Пары топлива
6. Зона горения.
На рис. а) приведена схема горения углерода. Процесс горения твердых топлив в зависимости от способа сжигания находится в диффузионной или промежуточной области.
На рис. б) приведена схема горения капли жидкого топлива. Вследствие того, что температура кипения жидкого топлива ниже температуры воспламенения, его капли сначала начинают испаряться, а затем возникает процесс горения топлива.
От величины поверхности горения зависит скорость горения, а величина поверхности горения зависит от степени распыления жидкого топлива (диспергирования). То есть, чем меньше распыление, тем больше скорость и полнота сгорания.
Реакция горения является цепной реакцией, которую впервые открыл Семенов Н.Н.
Отличительной особенностью реакций горения является то, что цепной механизм их протекания характеризуется тем, что реакция протекает не непосредственно между молекулами исходных веществ, а через промежуточные стадии, что позволяет обойти большой энергетический барьер, который необходимо преодолеть для осуществления прямой реакции между исходными компонентами
В цепных реакциях различают:
- зарождение цепей – образование активного продукта;
- разветвление цепей – увеличение концентрации активного продукта в результате реакции с исходным веществом;
- обрыв цепи – процесс, при котором молекулы активного продукта уничтожаются.
Реакция, при которой концентрация активно промышленного продукта остается постоянной и равной равновесному значению называется неразветвленной цепной реакцией.
|
|
|
Если в процессе реакции происходит увеличение активного промышленного продукта, то суммарная скорость реакции непрерывно возрастает. такая реакция называется разветвленной цепной реакцией. Разветвленной цепной реакцией является окисление водорода:
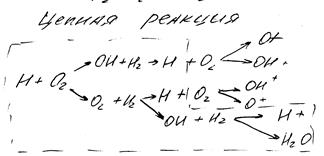
|
|
|


