 |
Константы Маделунга некоторых структурных типов
|
|
|
|
| Структурный тип | КЧ и КП | Константа Маделунга, А |
| CsCl (куб.) | 8, куб | 1,7627 |
| NaCl (куб.) | 6, октаэдр | 1,7476 |
| NiAs (гекс.) | 6, октаэдр и тригональная призма | 1,665 |
| ZnS (куб.) | 4, тетраэдр | 1,6380 |
| PtS (тетр.) | 4, плоский квадрат | 1,605 |
Величина А получается в результате суммирования бесконечного ряда, заключенного в скобки, зависит от геометрического типа структуры, но не зависит от межатомных расстояний. Она называется постоянной Маделунга, в честь ученого, который впервые рассчитал эти суммы. Для кристаллов со структурой хлорида натрия она равна 1,7476.
Чтобы найти энергию всей решетки нужно величину кулоновского взаимодействия j умножить на число ионов в молекуле (формульной единице, для NaCl - 2) и число Авогадро и разделить на 2, поскольку каждое парное взаимодействие относится к двум ионам, получим:

В этом выражении для краткости обычно опускают постоянный множитель Ne2. Значение энергии, вычисленное по приведенной формуле, правильно только при допущении, что ионы – твердые недеформируемые шары, кратчайшее расстоянии между которыми не может быть меньше R. Однако твердые тела сжимаемы, и ионы деформируются. По мере увеличения сжатия сопротивление кристалла растет. Ионы отталкиваются друг от друга, силы отталкивания возрастают по мере сближения ионов друг с другом. В 1918 году М. Борн и его сотрудники предложили две формулы для потенциала отталкивания: степенную  , и экспоненциальную
, и экспоненциальную  . Параметры b и n, В и r определяются на основании экспериментальных данных по сжимаемости кристалла.
. Параметры b и n, В и r определяются на основании экспериментальных данных по сжимаемости кристалла.
В состоянии равновесия энергия решетки равна:
 и
и 
Энергия решетки должна быть минимальна, то есть при равновесном межатомном расстоянии R0 должно выполняться условие:
|
|
|

Это означает равенство сил притяжения и отталкивания:
 и
и 
Отсюда выразим b и В, подставим их в уравнение для энергии решетки и получим:
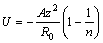 - уравнение Борна – Ланде.
- уравнение Борна – Ланде.
 - уравнение Борна – Майера.
- уравнение Борна – Майера.
Параметры n и r определяются из данных о сжимаемости кристалла, среднее значение n близко к 9 (от 5 до 12) и зависит от типа оболочки ионов. Для кристаллов, состоящих из разных ионов, берут среднее значение n. среднее значение r оказалось более постоянным и составляет 0,35 ± 0,05 A.
Экспериментально определить величину энергии кристаллической решетки позволяет процесс известный как цикл Борна - Габера. В общем виде для кристалла ионного кристалла МxAy энергия кристаллической решетки определяется как:  ,
,
где D Нат – энергия образования атомов из элементов в стандартных состояниях; m = x + y – число атомов в соединении;  - сумма потенциалов ионизации всех катионов;
- сумма потенциалов ионизации всех катионов;  - сумма значений сродства к электрону всех анионов.
- сумма значений сродства к электрону всех анионов.
Расчет энергии кристаллической решетки хлорида натрия
Согласно круговому процессу ионный кристалл NaCl, можно получить двумя различными способами:
● прямым взаимодействием металлического натрия и газообразного хлора, при котором выделяется энергия (-Q), соответствующая энтальпии образования DНf;
● переход от тех же состояний элементов к кристаллу через газовую фазу. В начале металл натрий переходит в одноатомный пар, для чего затрачивается энергия сублимации S; одновременно молекулы Cl2 диссоциируют на атомы, на этот процесс затрачивается энергия 1/2D. Далее атом натрия отдает один электрон и переходит в ион Na+ (энергия процесса равна потенциалу ионизации I). Атом хлора присоединяет этот электрон и образует ион Cl- (энергия процесса равна сродству к электрону Е). Ионы в газовой фазе взаимодействуют, образуя кристалл с выигрышем энергии решетки U.

Оба способа приводят к одному результату, по закону Гесса энергетические эффекты должны быть одинаковы: DНf = S + 1/2D + I – E + U
|
|
|
отсюда получим: U = DНf - S - 1/2D - I + E
Ковалентные кристаллы
Ковалентная химическая связь – и это связь, которая возникает между атомами за счет образования общих электронных пар.
Ковалентная связь существует между атомами, как в молекулах, так и в кристаллах. Она возникает как между одинаковыми атомами (например, H2, Cl2), так и между разными атомами (например, H2O, NH3, HCl). Почти все связи в органических соединениях – ковалентные.
Насыщаемость – одно и важнейших свойств ковалентной химической связи. Вследствие насыщаемости связи молекулы имеют определенный состав и существуют в виде дискретных частиц с определенной структурой. Каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар, таким образом, связь локализована между двумя атомами, то есть она двухцентровая и двухэлектронная. Количество связей ограничено числом валентных электронов и числом валентных орбиталей, поэтому связь насыщенна.
Направленность ковалентной связи связана с направленностью электронных облаков. Электронные облака имеют различную форму, и их взаимное перекрывание может осуществляться различными способами. В зависимости от способа перекрывания и симметрии образующегося облака различают  -,
-, 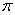 -,
-,  -связи.
-связи.
В гомоядерных двухатомных молекулах одна или несколько электронных пар в равной мере принадлежит обоим атомам. При образовании молекул H2, Cl2, F2 и др. каждое ядро атома с одинаковой силой притягивает пару связывающих электронов. Такая связь называется неполярной ковалентной связью:
О:: О, F: F.
Если взаимодействующие атомы характеризуются различными значениями электроотрицательности, то обобществленная пара электронов смещается к более электроотрицательному атому. Такая связь называется ковалентной полярной связью:

Вследствие смещения пары электронов от одного атома к другому, средняя плотность отрицательного заряда у одного из атомов будет выше, чем у другого. Поэтому один из атомов приобретает избыточный положительный, а другой избыточный отрицательный заряд. Эти заряды называются эффективными зарядами атомов:
+0,17H  Cl-0,17
Cl-0,17
|
|
|
Кристаллические вещества с ковалентным типом химической связи характеризуют диэлектрические или полупроводниковые свойства, средние значения твердости и плотности, низкая тепло- и электропроводность.
Энергия сцепления атомов, связанных ковалентно, измеряется в процессе диссоциации молекулы или сублимации кристалла с образованием одноатомного газа. Поэтому энергию сцепления ковалентного кристалла можно назвать энергией атомизации, чтобы отличить её от энергии ионной решетки, которая выделяется при образовании кристалла из газа ионов.
Расчет энергии ковалентного кристалла очень сложен, так как необходимо решение многих квантовомеханических задач. Поэтому до сих пор главными способами оценки ковалентной связи являются эмпирические методы. Опыт показывает, что равновесная энергия одинарной гомополярной связи находится в довольно простой линейной зависимости от её длины. Зависимость выражается приближенным уравнением:
Е (ккал) = - 38 R (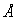 ) + 136
) + 136
Изменение энергии отдельной связи при изменении межатомного расстояния D R обычно передается с помощью функции Морзе:
 ,
,
где D – энергия диссоциации (D 0 = - E 0),  , где k – силовая константа связи, которая в свою очередь обратно пропорциональна квадрату длины связи:
, где k – силовая константа связи, которая в свою очередь обратно пропорциональна квадрату длины связи:  .
.
Молекулярные кристаллы
В молекулярных кристаллах существуют силы дополнительного взаимодействия между атомами, которые называют Ван-дер-ваальсовыми силами или остаточной связью. Кристаллами с такой связью являются водород, кислород, азот и молекулярные кристаллы большинства органических соединений. Именно остаточная связь, действующая между молекулами, обеспечивает существование таких кристаллов. Остаточная связь ненасыщаема и ненаправлена.
Для кристаллов с Ван-дер-Ваальсовыми связями характерны летучесть, легкоплавкость, отсутствие тепло- и электропроводности.
В теории реальных газов Ван-дер-Ваальса выражение для энергии взаимодействия включает два члена: один соответствует притяжению между молекулами, а второй – отталкиванию.
Для кристаллов с остаточной связью вклад от энергии отталкивания в энергию решетки можно представить также как для ионных кристаллов:  , где R – расстояние между центрами молекул.
, где R – расстояние между центрами молекул.
|
|
|
Выражение для энергии притяжения складывается из трех слагаемых:
U = U 1 + U 2 + U 3
Все три слагаемых связаны с дипольными взаимодействиями, но происхождение диполей различно.
U 1 – энергия ориентационных взаимодействий (обе молекулы полярны) - 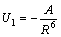 . Величина А положительна и зависит от величины дипольного момента молекул и температуры, она тем больше, чем больше дипольный момент и чем меньше температура.
. Величина А положительна и зависит от величины дипольного момента молекул и температуры, она тем больше, чем больше дипольный момент и чем меньше температура.
U 2 – энергия индукционных взаимодействий (одна молекула полярна) -  . Величина В зависит от дипольного момента молекул и их поляризуемости. Очевидно, что В меньше, чем А.
. Величина В зависит от дипольного момента молекул и их поляризуемости. Очевидно, что В меньше, чем А.
U 3 – энергия дисперсионных взаимодействий (две молекулы неполярны) -  . Величина С зависит от поляризуемости молекул и от собственной частоты колебаний молекул.
. Величина С зависит от поляризуемости молекул и от собственной частоты колебаний молекул.
В полярных молекулах наиболее сильна ориентационная составляющая, в неполярных – дисперсионная. При подсчете энергии решетки молекулярных кристаллов по формуле:
U = U 1 + U 2 + U 3 + Uотт
выяснилось, что U2  - Uотт, поэтому выражение приобретает вид:
- Uотт, поэтому выражение приобретает вид:
U = U 1 + U 3
Рассчитанные значения энергии очень малы и лежат в пределах нескольких килокалорий на моль, например для кристалла кислорода она равна 1,46 ккал/моль.
Металлические кристаллы
Металлическая химическая связь образуется между атомами металлов. При образовании кристаллической решетки атомы сближаются до касания, валентные орбитали соседних атомов перекрываются, в силу чего электроны свободно перемещаются с орбитали одного атома на свободную и близкую по энергии соседних атомов. В результате этого в кристаллической решетке металла возникают обобществленные свободные электроны, которые непрерывно перемещаются между положительно заряженными ионами узлов решетки, электростатически связывая их в единое целое.
Металлическая связь – нелокализованная химическая связь. Металл – плотноупакованная структура из катионов, погруженных в «электронный газ».
Металлическая связь характеризуется: ненаправленностью, ненасыщаемостью, небольшим числом валентных электронов и большим числом свободных орбиталей
Для металлических кристаллов характерны высокие координационные числа, плотные и плотнейшие упаковки частиц, высокие тепло- и электропроводность, ковкость, невысокие температуры плавления и кипения.
Теория химической связи в кристаллах металлов – зонная теория. Согласно зонной теории энергетические уровни, на которых находятся валентныеэлектроны, образуют валентную зону, над ней находится зона проводимости, которая образуется из совокупности несвязывающих орбиталей и может быть потенциально занята электронами. Если между ними существует энергетическая щель, не занятая электронами, то она называется запрещенной зоной.
|
|
|
Энергию взаимодействия атомов в типичном металле можно рассмотреть условно с позиций ионной модели, если считать, что электростатическое притяжение остовов и электронов приводит к возникновению сил притяжения. В рассматриваемой «ионной» модели металла притяжение можно оценить по уравнению:
 ,
,
где z – заряд остова, R – межъядерное расстояние, R /2 (радиус атома) - наиболее «вероятное» расстояние остов – электрон. Силы притяжения должны при некотором R = R 0 уравновешиваться силами отталкивания иного происхождения. Отталкивание между атомами можно считать обусловленным кинетическим движение электронного газа. Тогда силы отталкивания в металле сводятся к давлению электронного газа, зависящему от его плотности, но не от температуры. При предположении о чисто кинетической природе сил отталкивания в металлах энергия решетки металла представляется в виде:
 ,
,
и поскольку в состоянии равновесия кинетическая энергия составляет половину потенциальной, то получим:
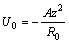 .
.
Для щелочных металлов энергия изменяется от 183 ккал/моль для лития до 105 ккал/моль для цезия.
|
|
|


