 |
Разновидности смога и их особенности
|
|
|
|
Смог (англ. Smoke - дым, fog - густой туман) - видимое загрязнение воздуха любого характера. Смог возникает при определенных условиях: большом количестве пыли и газов в воздухе и длительном существовании антициклонных условий погоды (областей с высоким атмосферным давлением), когда загрязнители скапливаются в приземном слое атмосферы. Смог вызывает удушье, приступе астмы, аллергические реакции, раздражение глаз, повреждение растительности, зданий и сооружений.
Выделяют три типа смога: ледяной (аляскинского типа); влажный (лондонского типа); сухой или фотохимический (лос-анжелесского типа).
Наиболее изучен влажный смог. Он обычен для мест с высокой относительной влажностью воздуха и частыми туманами. Это способствует смешению загрязняющих веществ, и взаимодействию химических реакций. Эти загрязняющие вещества, непосредственно выброшенные в атмосферу, они называются первичными загрязнителями. Главными токсическими компонентами влажного смога являются чаще всего CO2 и SO2. Печально знаменит случай, когда в 1952 г. влажный смог в Лондоне унес более 4000 жизней.
Фотохимический смог - вторичное загрязнение воздуха, возникающее в процессе разложения первичных загрязняющих веществ солнечными лучами. Главный ядовитый компонент - озон.
Ледяной смог возникает при очень низких температурах и антициклоне. В этом случае выбросы даже небольшого количества загрязняющих веществ приводят к возникновению густого тумана, состоящего из мельчайших кристаллов льда и, например, серной кислоты.
Воздух - в основном смесь О2 и N2. При высокой температуре пламени молекулы в воздухе могут распадаться и даже молекулы сравнительно инертного N2 подвергаются реакциям:
|
|
|

Согласно уравнению образуется атом кислорода, который входит в уравнение. Однажды возникший в пламени атом кислорода будет воссоздаваться и участвовать во всей цепочке реакции, приводящей к образованию NO. Если просуммировать эти две реакции, получим:

Уравнение показывает, как оксиды азота образуется в пламени. Они появляются потому, что топливо сжигается в воздухе а не в кислороде O2. Кроме того, некоторые топлива содержат соединения азота в качестве примесей, и в результате продукты сгорания этих примесей служат источником появления других оксидов азота. Окисление оксида азота в смоге дает диоксид азота, бурый газ. Этот цвет означает, что газ поглощает свет (с длинною волны не менее 310нм.), фотохимические активен и претерпевает диссоциацию:

Таким образом, согласно уравнению, вновь возникает оксид азота, но также одиночный и реакционноспособный атом кислорода, который может вступать в реакцию с образованием озона - O3:

Озон - это единственный загрязнитель, который наиболее ясно характеризует фотохимический смог. Однако О3, который представляет такую проблему, не выбрасывается автомобилем (или любым основным загрязнителем). Это вторичный загрязнитель.
Итак, летучие органические соединения, высвобождаемые благодаря использованию топлив на основе бензина, способствует превращению NO в NO2 (и лежат в основе фотохимического смога).
В процессе окисления углеводородов в атмосфере особо нужно отметить роль радикала OH*. Рассмотрим окисление метана (CH4) в качестве простого примера этого процесса:
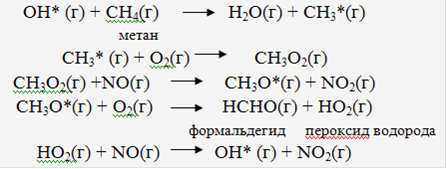
Эти реакции показывают превращение оксида азота (NO) в диоксид (NO2) и простого алкана типа СН4 в альдегид (в данном случае формальдегид HCHO). При этом радикал OH* воспроизводится в конце цепочки реакций, поэтому может считаться в некотором роде катализатором. Несмотря на то, что реакция протекает в фотохимическом смоге, воздействие радикала OH* на большие и сложные органические молекулы достаточно эффективно. Альдегиды также могут подвергаться воздействию радикалов OH*.
|
|
|

Метил-радикал (CH3*) из уравнения может возвращаться в уравнение.
Важным дополнением к этому ряду реакции является следующее:

приводящая к образованию раздражающего глаза пероксиацетилнетрата (ПАН).
|
|
|


