 |
Первая аналитическая группа катионов
|
|
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Оренбургский государственный университет
Е.В. САЛЬНИКОВА, А.В. СТРЯПКОВ
КАЧЕСТВЕННЫЙ АНАЛИЗ
КАТИОНОВ
Рекомендовано Учёным советом Оренбургского государственного университета в качестве учебного пособия для студентов, обучающихся по программам высшего профессионального образования по специальности “Химия”
Оренбург 2001
ББК 24.4я7
С 16
УДК 543.061(075.8)
Рецензент
кандидат технических наук, доцент Т.Ф. Тарасова
Сальникова Е.В., Стряпков А.В.
С16 Качественный анализ катионов: Учебное пособие.
– Оренбург: ОГУ, 2001.- 51 с.
ISBN…..
В пособии даны практические рекомендации по методам химической идентификации веществ на основе кислотно-щелочной системы анализа. Приведены характерные частные реакции катионов, схемы обнаружения элементов в сложных растворах и смесях. Пособие соответствует требованиям программы подготовки студентов по специальностям 011000 – химия.
С ----------------
ББК 24.4я7
ISBN
© Сальникова Е.В., 2001
Стряпков А.В.
© ОГУ, 2001
Содержание
Введение......................................................... 4
1 Первая аналитическая группа катионов.............................. 5
1.1 Частные реакции на катион Na+................................... 5
1.2 Частные реакции на катион K+....................................7
1.3 Частные реакции на катион NH4+.................................. 8
1.4 Контрольная задача. Анализ смеси катионов первой группы...........10
2 Вторая аналитическая группа катионов.............................. 12
2.1 Частные реакции на катион Ag+...................................13
2.2 Частные реакции на катион Hg22+...................................14
2.3 Частные реакции на катион Pb2+................................... 14
|
|
|
2.4 Контрольная задача. Анализ смеси катионов второй группы............16
3 Третья аналитическая группа катионов...............................17
3.1 Частные реакции на катион Ba2+................................... 18
3.2 Частные реакции на катион Sr2+................................... 19
3.3 Частные реакции на катион Ca2+................................... 19
3.4 Контрольная задача. Анализ смеси катионов третьей группы.......... 20
3.5 Контрольная задача. Анализ смеси катионов I, II, III групп............ 21
4 Четвёртая аналитическая группа катионов............................24
4.1 Частные реакции на катион Al3+................................... 24
4.2 Частные реакции на катион Cr3+................................... 26
4.3 Частные реакции на катион Zn2+...................................29
4.4 Частные реакции на катион Sn2+...................................30
4.5 Частные реакции на катион Sn4+...................................31
4.6 Частные реакции на катионы As3+ и As5+............................32
4.6 Контрольная задача. Анализ смеси катионов IV группы.............. 33
5 Пятая аналитическая группа катионов............................... 33
5.1 Частные реакции на катион Fe2+................................... 34
5.2 Частные реакции на катион Fe3+................................... 35
5.3 Частные реакции на катион Mn2+ ...................................36
5.4 Частные реакции на катион Bi3+....................................37
5.5 Частные реакции на катион Mg2+...................................38
5.6 Частные реакции на катион Sb3+................................... 39
5.7 Частные реакции на катион Sb5+................................... 39
5.8 Контрольная задача. Анализ смеси катионов V группы................ 40
6 Шестая аналитическая группа катионов.............................. 41
6.1 Частные реакции на катион Сu2+................................... 41
6.2 Частные реакции на катион Hg2+.................................. 42
6.3 Частные реакции на катион Cd2+ ................................... 43
6.4 Частные реакции на катион Co2+....................................44
6.5 Частные реакции на катион Ni2+....................................46
6.6 Контрольная задача. Анализ смеси катионов VI группы............... 47
6.7 Контрольная задача. Анализ смеси катионов IV, V, VI групп........... 47
7 Контрольная задача. Анализ смеси катионов I-VI групп.................49
|
|
|
8 Анализ неизвестного твёрдого вещества..............................54
Список использованных источников...................................51
Введение
Качественный анализ является начальным этапом изучения аналитической химии, его практическое значение важно и весьма разнообразно.
Предмет качественного анализа – развитие теоретических основ, усовершенствование существующих и разработка новых, более совершенных методов определения элементного состава веществ. Задача качественного анализа – обнаружение отдельных элементов или ионов, входящих в состав исследуемого соединения. Изучение неизвестного вещества всегда начинается с качественного анализа, так как от него зависит выбор метода количественного определения компонентов. Знание основных аналитических свойств элементов способствует развитию естественных наук – геохимии, геологии, минералогии, физики, металлургии, химической технологии, агрохимии, биологии, экологии, медицины и др.
Качественный анализ имеет большое методологическое и философское значение, поскольку изучение химических свойств и явлений в их взаимосвязи развивают наблюдательность, логическое мышление, способствуют развитию научного подхода к изучению природы.
Учебное пособие предназначено для студентов, обучающихся по специальности “Химия”, а также специальностям, требующим углубленного изучения аналитической химии. Оно составлено в соответствии с программой по аналитической химии на основе кислотно-щелочной системы анализа катионов.
Кислотно-щелочная система анализа имеет ряд преимуществ перед сульфидной. Во-первых, в ней более широко и разносторонне используются кислотно-основные свойства катионов, их амфотерность и способность к комплексообразованию, что даёт возможность полнее увязывать теоретические основы анализа с курсом общей и неорганической химии. Во-вторых, анализ катионов как по отдельным группам, так и на смесь катионов всех аналитических групп занимает значительно меньше времени, что также имеет большое значение при сравнительно небольшом количестве часов, отводимых на изучение этого раздела аналитической химии. В-третьих, в практикуме по качественному анализу почти полностью исключается применение сероводорода, работа с которым требует специально оборудованного помещения.
|
|
|
С целью экономии времени и реактивов практические работы по качественному анализу рассчитаны на использование полумикрохимического метода, в котором оперируют с пробами вещества массой 0,05-0,5 г и объемами растворов 1-10 мл.
Первая аналитическая группа катионов
К первой аналитической группе относятся катионы, не имеющие общего группового реактива (NH4+, Li+, Na+, K+, Rb+, Cs+). Все они, кроме иона NH4+, входят в первую группу периодической системы химических элементов Д. И. Менделеева и обладают ярко выраженными металлическими свойствами. Их ионы имеют законченные восьмиэлектронные оболочки. Большинство солей калия, натрия и аммония и их гидроксиды хорошо растворимы в воде. Гидроксиды калия и натрия – сильные щелочи, которые в водных растворах полностью ионизированы. Соли калия и натрия, образованные слабыми кислотами, подвергаются гидролизу, и растворы их имеют рН > 7. Соли же их, образованные сильными кислотами, не подвергаются гидролизу, и растворы их имеют нейтральную реакцию.
Раствор аммиака в воде (гидроксид аммония  ) – слабое основание. Соли, образованные им и сильными кислотами, подвергаются гидролизу, и растворы их имеют рН < 7. В отличие от солей калия и натрия, соли аммония разлагаются при нагревании, а поэтому могут быть удалены прокаливанием. Это свойство солей аммония используется для удаления катионов NH4+.
) – слабое основание. Соли, образованные им и сильными кислотами, подвергаются гидролизу, и растворы их имеют рН < 7. В отличие от солей калия и натрия, соли аммония разлагаются при нагревании, а поэтому могут быть удалены прокаливанием. Это свойство солей аммония используется для удаления катионов NH4+.
По некоторым аналитическим свойствам (большинство солей хорошо растворимы в воде) к этой группе близок магний, поэтому иногда ион Mg2+ включают в первую группу катионов.
1.1 Частные реакции на катион Na 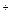
Дигидроантимонат калия 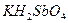
Возьмите 5-6 капель раствора соли натрия, прибавьте такой же объем раствора дигидроантимоната калия 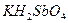 и потрите стенки пробирки внутри стеклянной палочкой. Выпадает белый кристаллический осадок дигидроантимоната натрия:
и потрите стенки пробирки внутри стеклянной палочкой. Выпадает белый кристаллический осадок дигидроантимоната натрия:



Условия проведения реакции:
1. Анализируемый раствор должен быть достаточно концентрированным (разбавленный раствор нужно предварительно упарить).
|
|
|
2. Реакцию следует проводить без нагревания (лучше на холоду).
3. Среда раствора должна быть нейтральной. Кислоты разлагают дигидроантимонат калия с образованием белого аморфного осадка метасурьмяной кислоты  :
:


Щелочи (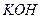 или
или 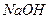 ) растворяют осадок
) растворяют осадок  , так как образуется средняя соль
, так как образуется средняя соль  или
или  .
.
4. Необходимо применять механическое воздействие, вызывающее ускорение кристаллизации осадка (трение палочкой о стенки пробирки).
5. Многие катионы мешают анализу, поэтому обнаружение натрия в смеси проводят после отделения катионов других групп.
|
|
|


