 |
Лекция №3. Реальные газы, водяной пар, влажный воздух, течение газов
|
|
|
|
Не всегда газ, даже с определенными допущениями, можно считать идеальным. Довольно часто в технике отклонения в характере поведения реальных газов от идеальных могут приводить к ощутимым ошибкам и расчеты давать недостоверные результаты.
Состояние реального газа описывается уравнениям состояния реальных газов, полученных экспериментальным путем. В общем случае:
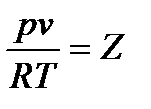
Строгого математического вывода коэффициента сжимаемости Z не существует. Поэтому в технике используют экспериментально полученные зависимости, например, Боголюбова, Новикова, Бертло и др. Нужно сказать, что эти уравнения достаточно достоверно описывают состояние определенных реальных газов в конкретных условиях, но они не универсальны.
Состояние реального газа достаточно хорошо, если не с количественной, то с качественной стороны характеризует уравнение Ван-дер-Ваальса, предложенное им в 1873 г.
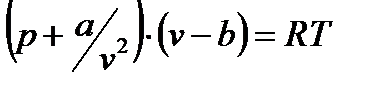
Где 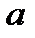 и
и 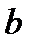 - постоянные для данного газа величины, причем
- постоянные для данного газа величины, причем 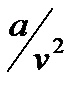 – поправка, учитывающая силы сцепления между молекулами, а
– поправка, учитывающая силы сцепления между молекулами, а 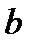 – поправка, учитывающая объем самих молекул. Легко увидеть в этом уравнении знакомое уравнение Клапейрона. Очевидно, что уравнение Ван-дер-Ваальса – кубическое, а, следовательно, при определенных
– поправка, учитывающая объем самих молекул. Легко увидеть в этом уравнении знакомое уравнение Клапейрона. Очевидно, что уравнение Ван-дер-Ваальса – кубическое, а, следовательно, при определенных  и
и 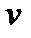 оно имеет три корня. Получается кажущийся парадокс, а именно: если, корни уравнения не равны между собой и не мнимые, то при определенных температуре и давлении, вещество может иметь три различных объема. Однако это противоречие кажущееся. Два из трех различных значений объема соответствуют различным состояниям вещества: газообразному и жидкому, а третий объем – промежуточное значение, которое в опыте неосуществимо. Если три корня уравнения окажутся равными друг другу, то вещество находится в критическом состоянии, о котором поговорим далее. Если два корня уравнения – мнимые то это вещество – газ.
оно имеет три корня. Получается кажущийся парадокс, а именно: если, корни уравнения не равны между собой и не мнимые, то при определенных температуре и давлении, вещество может иметь три различных объема. Однако это противоречие кажущееся. Два из трех различных значений объема соответствуют различным состояниям вещества: газообразному и жидкому, а третий объем – промежуточное значение, которое в опыте неосуществимо. Если три корня уравнения окажутся равными друг другу, то вещество находится в критическом состоянии, о котором поговорим далее. Если два корня уравнения – мнимые то это вещество – газ.
|
|
|
В качестве реального газа рассмотрим водяной пар. Представим закрытую термодинамическую систему, в объем которой залита вода. Молекулы жидкости, также как и молекулы газа, находятся в хаотическом движении. Если над жидкостью есть свободное пространство, то наиболее подвижные молекулы способны покинуть объем жидкости и перейти в свободное пространство над поверхностью раздела. При этом объем жидкости, естественно, будет уменьшаться. Такой процесс называется испарением. Какое-то количество испарившихся молекул возвращаются обратно в жидкость и, в какой-то момент времени, этот процесс придет в равновесие, т.е. количество молекул покинувших жидкость и вернувшихся в нее сравняется. Такое состояние называется насыщением, а образовавшийся пар – насыщенным. Таким образом, насыщенный пар находится в динамическом равновесии с жидкостью. Давление и плотность насыщенного пара при определенной температуре принимают совершенно конкретные значения.
Зависимость термодинамических параметров насыщенного пара совершенно иная, нежели у идеального газа. К примеру, если мы попытаемся при постоянной температуре уменьшить объем пространства, занимаемого насыщенным паром, то вопреки ожиданиям, давление его не изменится, а некоторая определенная часть молекул насыщенного пара перейдет в жидкость. В этом случае говорят, что пар конденсируется.
Рассмотрим, что будет происходить с жидкостью, помещенной в объем цилиндра с подвижным поршнем при изменении температуры при постоянном давлении. Отобразим этот процесс в  диаграмме, рис. 3.1.
диаграмме, рис. 3.1.
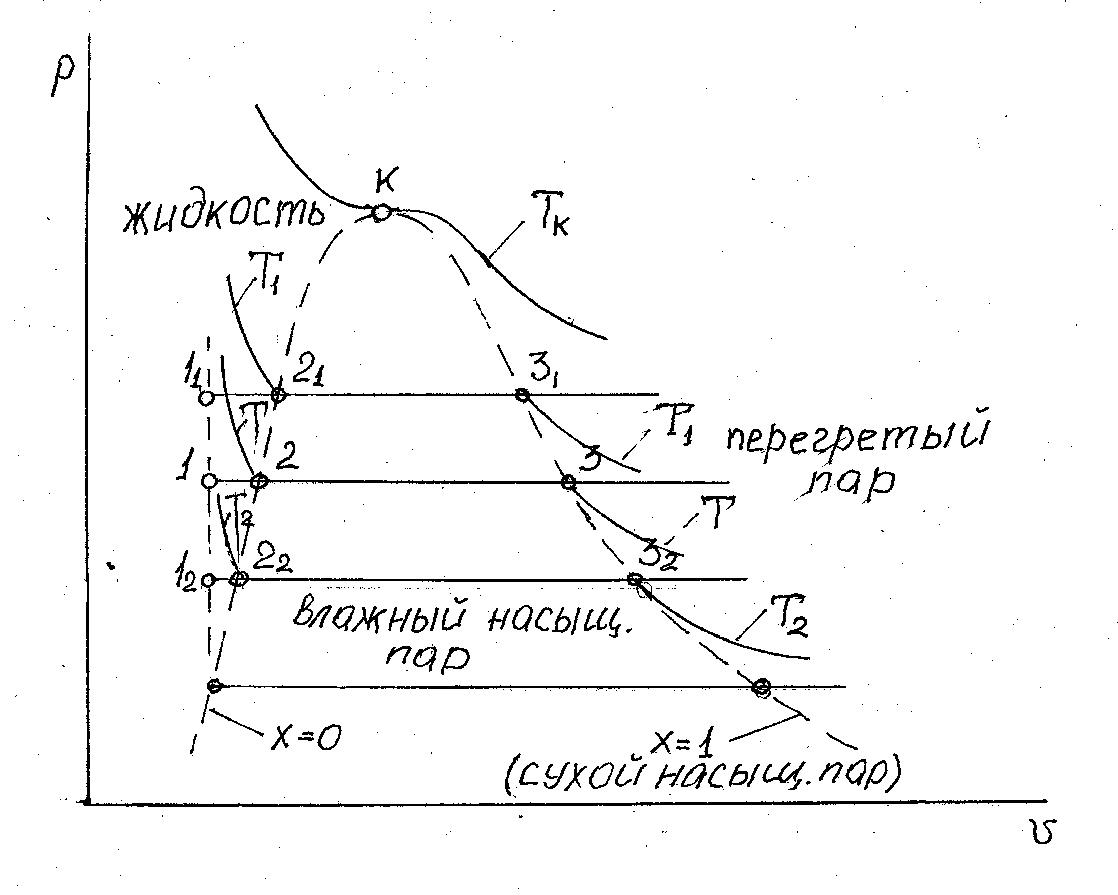
Рис. 3.1. Диаграмма фазового перехода
По мере подвода тепла и соответствующего повышения температуры при давлении 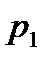 , жидкость начнет увеличивать свой объем. Этот процесс будет происходить до определенной температуры, при которой давление насыщенного пара не сравняется с давлением
, жидкость начнет увеличивать свой объем. Этот процесс будет происходить до определенной температуры, при которой давление насыщенного пара не сравняется с давлением  (или, точнее, незначительно его превысит). При этих условиях в объеме жидкости возможно образование пузырьков насыщенного пара. Понятно, что при давлении насыщенного пара менее чем давление окружающей среды, образование таких объемов насыщенного пара в жидкости невозможно, т.к. они были бы моментально сжаты внешним давлением. Такое состояние жидкости с образованием насыщенного пара в ее объеме называется процессом кипения или просто кипением. Отобразим это на диаграмме точкой 2. По мере дальнейшего подвода тепла от точки 2 начинается образование пара из объема жидкости, при этом температура системы меняться не будет, а вся подведенная тепловая энергия будет затрачена на процесс образования насыщенного пара. Эта неизменная температура называется температурой кипения -
(или, точнее, незначительно его превысит). При этих условиях в объеме жидкости возможно образование пузырьков насыщенного пара. Понятно, что при давлении насыщенного пара менее чем давление окружающей среды, образование таких объемов насыщенного пара в жидкости невозможно, т.к. они были бы моментально сжаты внешним давлением. Такое состояние жидкости с образованием насыщенного пара в ее объеме называется процессом кипения или просто кипением. Отобразим это на диаграмме точкой 2. По мере дальнейшего подвода тепла от точки 2 начинается образование пара из объема жидкости, при этом температура системы меняться не будет, а вся подведенная тепловая энергия будет затрачена на процесс образования насыщенного пара. Эта неизменная температура называется температурой кипения - 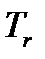 . Обратим внимание, на то, что мы рассматриваем процесс при
. Обратим внимание, на то, что мы рассматриваем процесс при  , т.е. температура кипения свойственна именно этому давлению
, т.е. температура кипения свойственна именно этому давлению  при ином давлении эта температура будет другой. Таким образом, если между точками 1 и 2 мы имели жидкость, то после точки 2 наша система содержит две фазы – насыщенный пар и кипящую жидкость, причем жидкость может быть не только внизу цилиндра, но распылена по стенкам цилиндра. Такой насыщенный пар, содержащий в себе жидкость, называется влажным насыщенным паром. По мере дальнейшего подвода теплоты мы достигнем состояния системы, когда вся жидкость превратиться в пар. Обозначим эту точку – 3, а пар в этой точке назовем сухим насыщенным паром. За точкой 3 на диаграмме находится область перегретого пара. Перегретый пар, по своему поведению не отличим от обычного газа, а при определенных условиях, может рассматриваться как идеальный газ. А это значит, что при изобарном подводе тепла, с ростом
при ином давлении эта температура будет другой. Таким образом, если между точками 1 и 2 мы имели жидкость, то после точки 2 наша система содержит две фазы – насыщенный пар и кипящую жидкость, причем жидкость может быть не только внизу цилиндра, но распылена по стенкам цилиндра. Такой насыщенный пар, содержащий в себе жидкость, называется влажным насыщенным паром. По мере дальнейшего подвода теплоты мы достигнем состояния системы, когда вся жидкость превратиться в пар. Обозначим эту точку – 3, а пар в этой точке назовем сухим насыщенным паром. За точкой 3 на диаграмме находится область перегретого пара. Перегретый пар, по своему поведению не отличим от обычного газа, а при определенных условиях, может рассматриваться как идеальный газ. А это значит, что при изобарном подводе тепла, с ростом  будет увеличиваться температура перегретого пара. Если мы проведем серию опытов по нагреву цилиндра, заполненного водой, при разных давлениях, то получим семейство изобар с характерными точками 1n, 2n, 3n. Объединив все точки 2n и 3n на поле наших характеристик, мы получаем пограничные кривые - границы разделов, где существует жидкость, влажный насыщенный пар и перегретый пар. Введем для влажного насыщенного пара понятие степень сухости и обозначим степень сухости пара –
будет увеличиваться температура перегретого пара. Если мы проведем серию опытов по нагреву цилиндра, заполненного водой, при разных давлениях, то получим семейство изобар с характерными точками 1n, 2n, 3n. Объединив все точки 2n и 3n на поле наших характеристик, мы получаем пограничные кривые - границы разделов, где существует жидкость, влажный насыщенный пар и перегретый пар. Введем для влажного насыщенного пара понятие степень сухости и обозначим степень сухости пара – 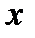 . Степень сухости пара представляет собой отношение массы сухого насыщенного пара
. Степень сухости пара представляет собой отношение массы сухого насыщенного пара  к массе влажного насыщенного пара
к массе влажного насыщенного пара  :
:
|
|
|
|
|
|
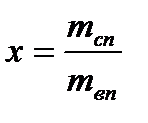
Тогда на пограничной кривой раздела жидкости и влажного насыщенного пара сухого насыщенного пара нет и 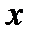 = 0. На пограничной линии влажный насыщенный пар – перегретый пар – весь пар является сухим насыщенным, а влажного насыщенного пара уже нет, таким образом,
= 0. На пограничной линии влажный насыщенный пар – перегретый пар – весь пар является сухим насыщенным, а влажного насыщенного пара уже нет, таким образом,  = 1. Условимся все параметры на пограничной линии
= 1. Условимся все параметры на пограничной линии 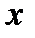 = 0 обозначать с одним штрихом, а на линии
= 0 обозначать с одним штрихом, а на линии  = 1 – с двумя штрихами.
= 1 – с двумя штрихами.
При проведении нашей серии опытов при понижении давления мы достигнем такого давления, когда влажный насыщенный пар начнет образовываться уже при температуре, когда возможно существование твердой фазы. Точка, в которой возможно существование в динамическом равновесии сразу трех фаз состояния вещества называют тройной точки и для воды параметры состояния в тройной точке принимают значение ТF = 273,16 К и рF =610,8 Па.
С другой стороны, при повышении давления, достигаем такой точки, где сходятся две пограничные линии  = 0 и
= 0 и 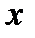 = 1. Эта точка называется критической. Критическая точка характеризуется отсутствием границы раздела между жидкой и газообразной фазами, а удельные объемы жидкости и насыщенного пара в критической точке становятся одинаковыми. Параметры в точке называют критическими. Так для воды критическая температура Тк = 647,3 К, а критическое давление рк = 22,129 МПа.
= 1. Эта точка называется критической. Критическая точка характеризуется отсутствием границы раздела между жидкой и газообразной фазами, а удельные объемы жидкости и насыщенного пара в критической точке становятся одинаковыми. Параметры в точке называют критическими. Так для воды критическая температура Тк = 647,3 К, а критическое давление рк = 22,129 МПа.
То количество теплоты, которое нужно подвести к одному кг жидкости, находящейся при температуре кипения при постоянном давлении для превращения ее в сухой насыщенный пар называется удельной теплотой парообразования:
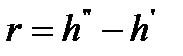
Исследуемый процесс можно отобразить в  и
и  диаграммах. Последняя удобна для определения функций состояния системы. Так, для определения функций состояния в
диаграммах. Последняя удобна для определения функций состояния системы. Так, для определения функций состояния в 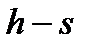 диаграмме для влажного насыщенного пара достаточно знать давление или температуру и степень сухости (
диаграмме для влажного насыщенного пара достаточно знать давление или температуру и степень сухости (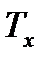 или
или  ); для сухого насыщенного пара – степень сухости
); для сухого насыщенного пара – степень сухости  = 1, поэтому достаточно знать или
= 1, поэтому достаточно знать или 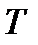 , или
, или  и, наконец, для перегретого пара нужно знать и
и, наконец, для перегретого пара нужно знать и  и
и 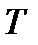 .
.
|
|
|
Также величины, характеризующие состояние влажного насыщенного пара определяются из выражений:
- для удельного объема: 
-для удельной энтальпии: 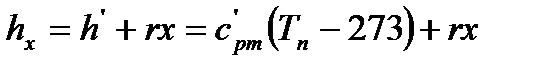
- для удельной энтропии: 
где 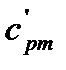 – средняя в диапазоне температур (273 -
– средняя в диапазоне температур (273 -  ) удельная изобарная теплоемкость воды.
) удельная изобарная теплоемкость воды.
В большинстве тепловых двигателей в качестве рабочего тела выступает воздух. Рассмотрим основные понятия, связанные с воздухом.
Сухой воздух это характерная смесь газов без примесей молекул воды (водяного пара). Смесь сухого воздуха с водяным паром называется влажным воздухом. При малом парциальном давлении водяного пара смесь можно рассматривать как идеальный газ.
Если мы возьмем такой объем влажного воздуха, который бы содержал 1 кг сухого воздуха и 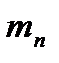 грамм пара, то масса водяного пара, находящегося в таком объеме влажном воздуха, называется влагосодержанием, обозначается
грамм пара, то масса водяного пара, находящегося в таком объеме влажном воздуха, называется влагосодержанием, обозначается 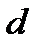 и измеряется в граммах на кг. Значение влагосодержания можно определить следующим образом. Пусть в объеме влажного воздуха
и измеряется в граммах на кг. Значение влагосодержания можно определить следующим образом. Пусть в объеме влажного воздуха  , находящегося под давлением
, находящегося под давлением  и имеющего
и имеющего 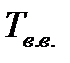 содержится
содержится 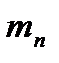 грамм водяного пара и
грамм водяного пара и  кг сухого воздуха. Запишем уравнение состояния для сухого воздуха и водяного пара.
кг сухого воздуха. Запишем уравнение состояния для сухого воздуха и водяного пара.
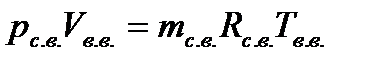
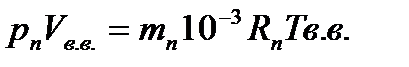
Разделив почленно записанные уравнения, получим выражение для определения влагосодержания:
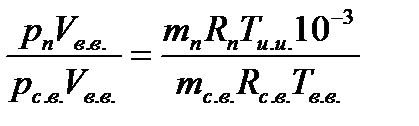
следовательно:
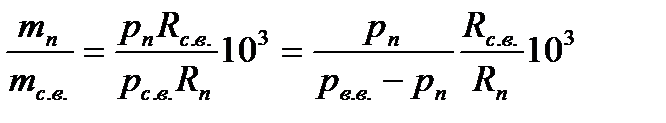
и тогда
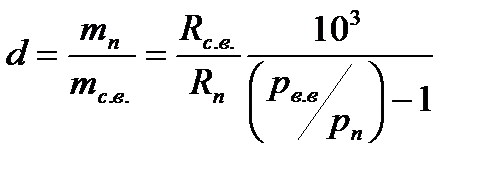
Максимальное влагосодержание воздуха при определенной температуре будет достигнуто тогда, когда пар во влажном воздухе станет насыщенным, т.е. парциальное давление пара в смеси станет равно парциальному давлению сухого насыщенного пара. Такой влажный воздух называется насыщенным влажным воздухом и влагосодержание его максимально. Очевидно, что повышение температуры влажного насыщенного воздуха будет сопровождаться повышением давления пара и, следовательно, пар перейдет в состояние перегретого, если влагосодержание его останется постоянным. Если с повышением температуры воздух останется влажным насыщенным, то влагосодержание его возрастет.
Масса водяного пара в граммах в одном м 3 влажного воздуха называется абсолютной влажностью воздуха, обозначается a и выражается в граммах на кубический метр. Ясно, что максимальную абсолютную влажность при конкретной температуре будет иметь влажный насыщенный воздух с сухим насыщенным паром. Тогда отношение абсолютной влажности влажного воздуха к абсолютной влажности насыщенного воздуха называется относительной влажностью воздуха  , выражается в %. При понижении температуры влажного воздуха, который содержит перегретый пар, сначала он достигнет состояния влажного насыщенного воздуха с сухим насыщенным паром, а при дальнейшем понижении температура пар в воздухе станет влажным насыщенным, т е. воздух будет характеризоваться наличием капель влаги – тумана. Температура, при которой из воздуха начинает выделяться влага в виде тумана, называют температурой точки росы,
, выражается в %. При понижении температуры влажного воздуха, который содержит перегретый пар, сначала он достигнет состояния влажного насыщенного воздуха с сухим насыщенным паром, а при дальнейшем понижении температура пар в воздухе станет влажным насыщенным, т е. воздух будет характеризоваться наличием капель влаги – тумана. Температура, при которой из воздуха начинает выделяться влага в виде тумана, называют температурой точки росы,  и обычно выражается в оС.
и обычно выражается в оС.
|
|
|
Таблицы параметров и диаграммы состояния влажного воздуха доступны в справочниках. Наиболее удобными для расчетов и общепринятыми теплотехниками являются диаграммы  , предложенные в 1918 г. проф. Л.К.Рамзиным, рис. 3.2. Диаграммы Рамзина требуют некоторых разъяснений.
, предложенные в 1918 г. проф. Л.К.Рамзиным, рис. 3.2. Диаграммы Рамзина требуют некоторых разъяснений.
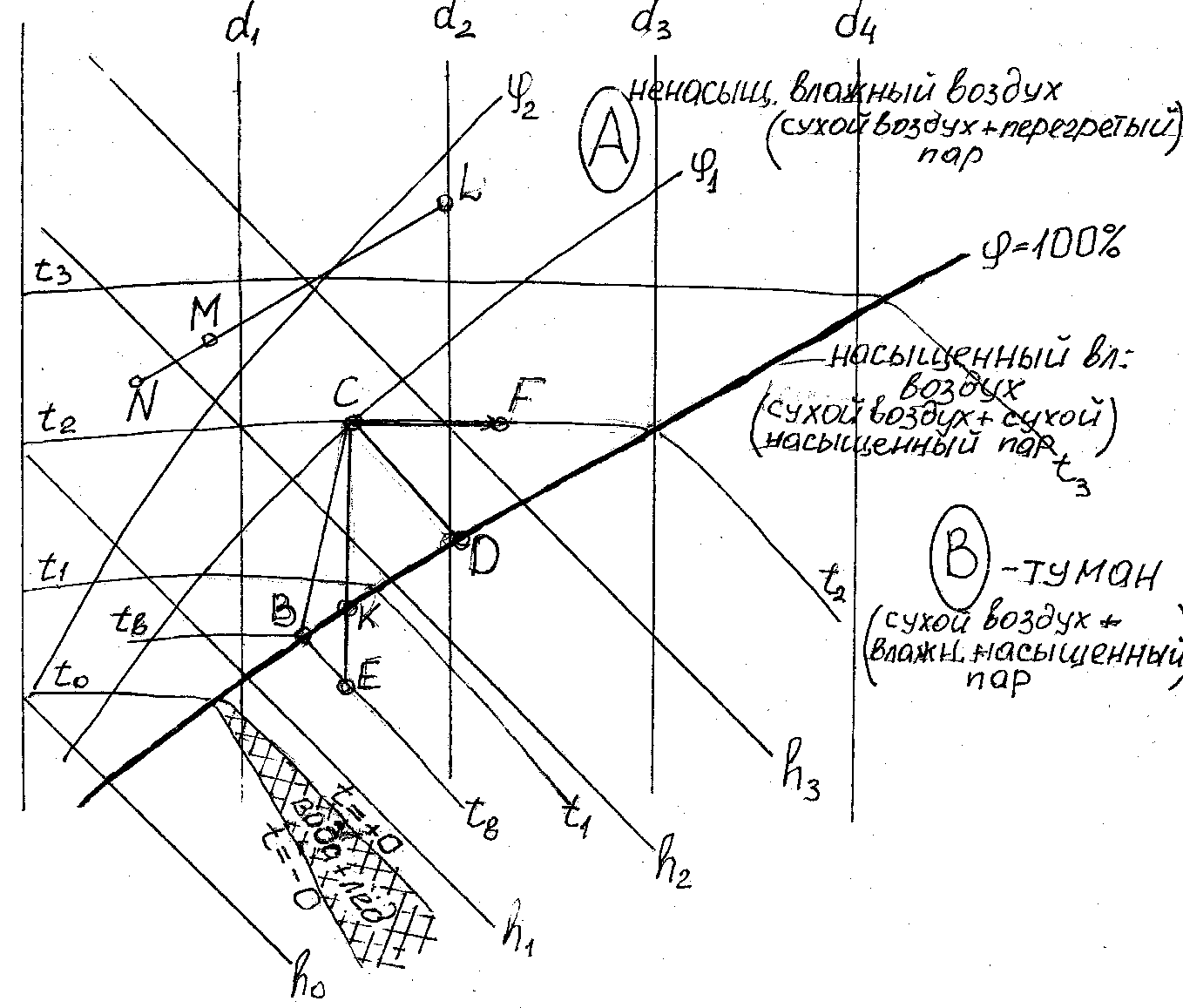
Рис.3.2. Диаграмма состояния влажного воздуха
По оси ординат на них откладывается удельная энтальпия, по оси абсцисс – влагосодержание. Для расширения поля диаграммы ось абсцисс повернута на 135о относительно оси ординат, на диаграмме ее не проводят а заменяют горизонтальной линией, на которой отложен масштаб влагосодержания. Диаграммы построены для разных давлений (обычно, для 745 и 760 мм рт. ст., что соответствует 99,3 и 101,3 КПа). Линия  = 100% делит поле диаграммы на область ненасыщенного влажного воздуха, содержащего перегретый пар (область А) и на область влажного воздуха с насыщенным влажным паром, т.е. область тумана (область В). Есть еще одна особая область, находящаяся между двумя изотермами
= 100% делит поле диаграммы на область ненасыщенного влажного воздуха, содержащего перегретый пар (область А) и на область влажного воздуха с насыщенным влажным паром, т.е. область тумана (область В). Есть еще одна особая область, находящаяся между двумя изотермами 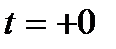 и Т
и Т 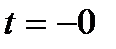 , в которой присутствуют одновременно сухой воздух, влажный насыщенный пар и кристаллы льда.
, в которой присутствуют одновременно сухой воздух, влажный насыщенный пар и кристаллы льда.
Допустим, воздух имеет параметры, соответствующие точке С на  диаграмме, то при охлаждении влажного воздуха, его влагосодержание остается постоянным, вплоть до точки К, пока относительная влажность не достигнет 100% (до температуры точки росы). Линия этого процесса на диаграмме вертикальна – С-К. Если продолжать охлаждение воздуха, например, до температуры tв, то получится туман, а влажный насыщенный воздух при этом будет иметь параметры, соответствующие точке В. В этом случае количество выделившейся из влажного насыщенного воздуха влаги будет определяться разностью влагосодержания между точками Е и В. В случае отделения влаги, процесс охлаждения влажного воздуха между температурами
диаграмме, то при охлаждении влажного воздуха, его влагосодержание остается постоянным, вплоть до точки К, пока относительная влажность не достигнет 100% (до температуры точки росы). Линия этого процесса на диаграмме вертикальна – С-К. Если продолжать охлаждение воздуха, например, до температуры tв, то получится туман, а влажный насыщенный воздух при этом будет иметь параметры, соответствующие точке В. В этом случае количество выделившейся из влажного насыщенного воздуха влаги будет определяться разностью влагосодержания между точками Е и В. В случае отделения влаги, процесс охлаждения влажного воздуха между температурами 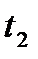 и
и 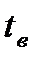 этот процесс на диаграмме Рамзина отобразится условно отрезком С-В. Если во влажном воздухе произвести распыление воды, то вода начнет испаряться (если воздух не является влажным насыщенным), так как пар во влажном воздухе в состоянии перегретого пара. Учитывая, что можно принять удельную энтальпию воды ничтожной по сравнению с удельной энтальпией воздуха, а теплота воздуха, затраченная на испарение воды, возвращается к нему с испаренной влагой, то процесс можем рассматривать как изоэнтальпийный. И такой процесс отобразится на диаграмме в виде отрезка С-D. С другой стороны, если воздух в состоянии точки С увлажнять паром, то температура воздуха практически не изменится и на диаграмме изотермический процесс отображается С-F. И. наконец, рассмотрим смешивание двух потоков воздуха с параметрами, характеризуемыми точками N и L. То параметры потока определятся точкой М, лежащей на отрезке N-L, а соотношение длин отрезков NM и ML, равно соотношению массовых расходов потоков, причем точка М лежит ближе к параметрам потока, имеющего больший массовый расход.
этот процесс на диаграмме Рамзина отобразится условно отрезком С-В. Если во влажном воздухе произвести распыление воды, то вода начнет испаряться (если воздух не является влажным насыщенным), так как пар во влажном воздухе в состоянии перегретого пара. Учитывая, что можно принять удельную энтальпию воды ничтожной по сравнению с удельной энтальпией воздуха, а теплота воздуха, затраченная на испарение воды, возвращается к нему с испаренной влагой, то процесс можем рассматривать как изоэнтальпийный. И такой процесс отобразится на диаграмме в виде отрезка С-D. С другой стороны, если воздух в состоянии точки С увлажнять паром, то температура воздуха практически не изменится и на диаграмме изотермический процесс отображается С-F. И. наконец, рассмотрим смешивание двух потоков воздуха с параметрами, характеризуемыми точками N и L. То параметры потока определятся точкой М, лежащей на отрезке N-L, а соотношение длин отрезков NM и ML, равно соотношению массовых расходов потоков, причем точка М лежит ближе к параметрам потока, имеющего больший массовый расход.
Рассмотрим далее течение газов. А для этого представим канал произвольной формы, по которому протекает газ. Для вывода уравнений, описывающих течение газа, введем допущения о том, что трение в канале отсутствует, газ идеальный и наша термодинамическая система представляет собой открытую термодинамическую систему и процессы в ней обратимы. Выделим два произвольных сечения площадью 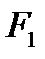 и
и 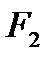 .
.
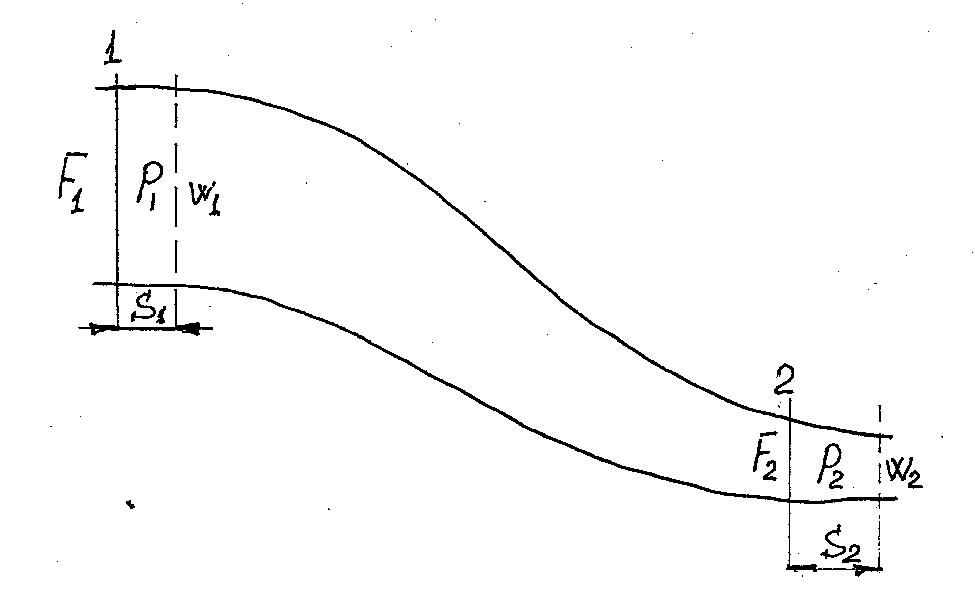
Рис. 3.3. Течение газа в канале
При этом газ в сечениях 1 и 2, выделенных на рис. 3.3 имеет скорости и давления 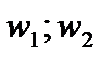 и
и 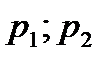 соответственно и воспользуемся законом сохранения энергии или, иначе, первой основой термодинамики в виде:
соответственно и воспользуемся законом сохранения энергии или, иначе, первой основой термодинамики в виде:
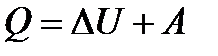
Детализируем работу 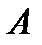 , которая состоит собственно из работы по перемещению газа (иногда называют работой проталкивания)
, которая состоит собственно из работы по перемещению газа (иногда называют работой проталкивания)  , работы по изменению кинетической энергии газа
, работы по изменению кинетической энергии газа  и работы по преодолению перепада высот
и работы по преодолению перепада высот  . Работа по перемещению газа в сечении на элементарное расстояние
. Работа по перемещению газа в сечении на элементарное расстояние  составит:
составит:  , обратим внимание на то, что работа совершается из вне над системой, поэтому она отрицательна, работа на выходе из системы совершает система, следовательно, она положительна и составит соответственно:
, обратим внимание на то, что работа совершается из вне над системой, поэтому она отрицательна, работа на выходе из системы совершает система, следовательно, она положительна и составит соответственно: 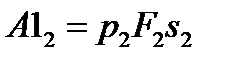 . Работа
. Работа 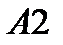 по изменению кинетической энергии газа описывается уравнением:
по изменению кинетической энергии газа описывается уравнением:
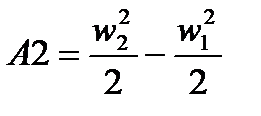
Работу по преодолению разности высот обозначим как:
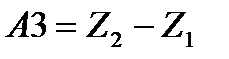
Тогда, подставив значение детализированных работ в уравнение сохранения энергии, и, принимая во внимание, что произведение  на
на  есть не что иное, как объем, получаем:
есть не что иное, как объем, получаем:
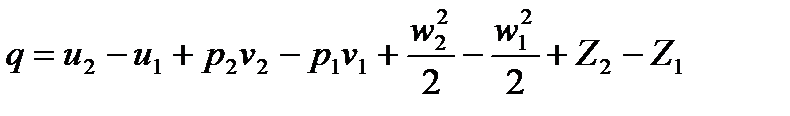
Рассмотрим адиабатное течение газа и, значит положим 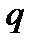 = 0, тогда можно перегруппировать члены уравнения и вывести, что
= 0, тогда можно перегруппировать члены уравнения и вывести, что

Позволим себе продифференцировать это выражение, и получаем закон сохранения энергии в дифференциальной форме.
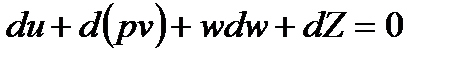
Нужно сказать, что в технике редко используют большие перепады высот, поэтому, пренебрегая соответствующим членом уравнения и, памятуя, что  , запишем, что:
, запишем, что:
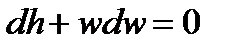
Далее вспомним, что в адиабатном процессе изменение внутренней энергии системы 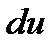 идет только на совершение работы, а, следовательно,
идет только на совершение работы, а, следовательно,
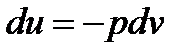
тогда подставим это выражение в дифференциальное уравнение сохранения энергии
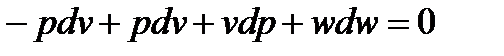
или
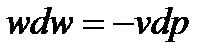
Рассматривая нашу термодинамическую систему, мы полагали, что массовый расход газа через выбранные сечения постоянен  , а объемный расход
, а объемный расход 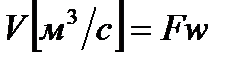 , тогда уместно будет, что
, тогда уместно будет, что
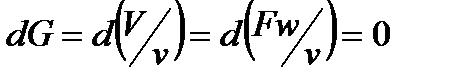
Продифференцируем и получим
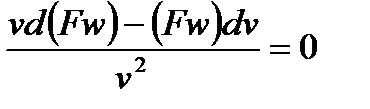
и далее:
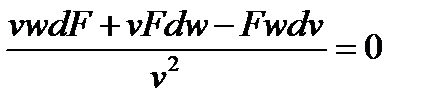
Выполнив математические преобразования, получим уравнение неразрывности:
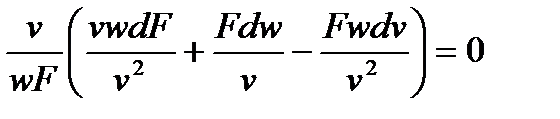
или

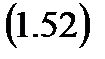
Теперь вернемся к уравнению первого закона термодинамики для адиабатного течения газа (1.51) и, для начала умножим его правую и левую части на 1/w2, получим:
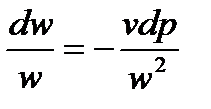
Далее умножим и разделим правую часть равенства на kp:
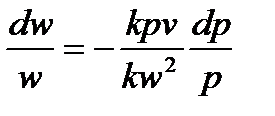
Но из физики известно, что местная скорость звука в газе 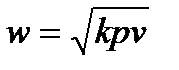 . Введем отношение скорости течения газа к скорости звука, обозначим это отношение
. Введем отношение скорости течения газа к скорости звука, обозначим это отношение 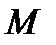 и назовем его числом Маха, т.е.:
и назовем его числом Маха, т.е.:  и тогда:
и тогда:
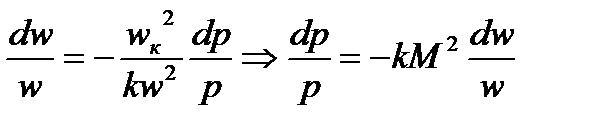
Теперь подставим это значение в уравнение неразрывности, а для этого вспомним, что 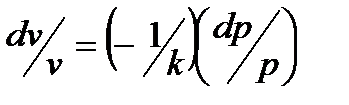 , можем исключить
, можем исключить  :
:
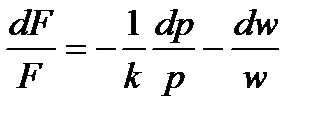
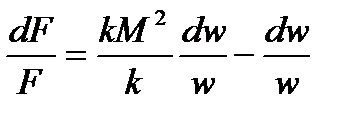
или:
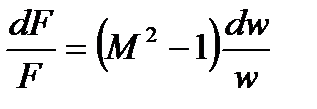
Аналогично можем исключить из рассмотрения  .
.
Так как:
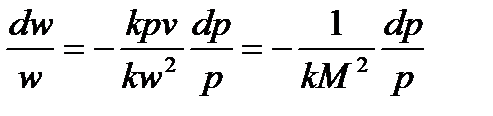
тогда:
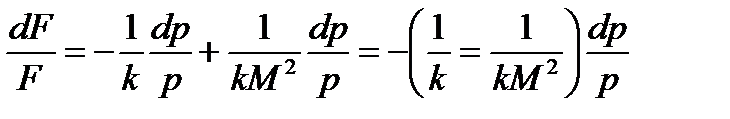
Следовательно:
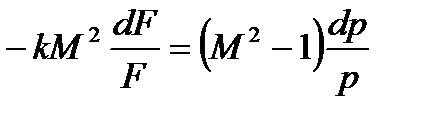
Рассмотрим более пристально полученные зависимости. Допустим  , т.е. течение в нашем канале дозвуковое, тогда
, т.е. течение в нашем канале дозвуковое, тогда  отрицательное. Следовательно, если
отрицательное. Следовательно, если 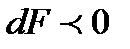 , иными словами говоря, канал сужается, а такие каналы называют соплами, то скорость увеличивается и
, иными словами говоря, канал сужается, а такие каналы называют соплами, то скорость увеличивается и  , при этом
, при этом 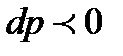 т.е. давление падает. Таким образом, при адиабатном дозвуковом течении газа в сопле увеличивается скорость газа, а давление понижается, тогда в расширяющемся канале, а он в технике называется диффузор, происходит в строгом соответствии с полученными зависимостями снижение скорости течения газа при одновременном увеличении давления. Если скорость течения в сопле достигает при определенных условиях скорости звука,
т.е. давление падает. Таким образом, при адиабатном дозвуковом течении газа в сопле увеличивается скорость газа, а давление понижается, тогда в расширяющемся канале, а он в технике называется диффузор, происходит в строгом соответствии с полученными зависимостями снижение скорости течения газа при одновременном увеличении давления. Если скорость течения в сопле достигает при определенных условиях скорости звука, 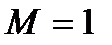 , то выражение
, то выражение 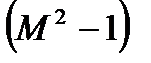 становится равным нулю и тогда правая часть наших уравнений превращается в 0 и
становится равным нулю и тогда правая часть наших уравнений превращается в 0 и 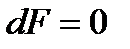 . Такое течение называется критическим и все параметры, относящиеся к этому состоянию, называют критическими. Из этого следует важное заключение, что получить сверхзвуковую скорость в сужающемся канале невозможно, а можно только достичь скорости звука. Теперь рассмотрим сверхзвуковой поток с
. Такое течение называется критическим и все параметры, относящиеся к этому состоянию, называют критическими. Из этого следует важное заключение, что получить сверхзвуковую скорость в сужающемся канале невозможно, а можно только достичь скорости звука. Теперь рассмотрим сверхзвуковой поток с 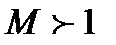 . В этом случае выражение
. В этом случае выражение 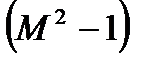 становится положительным. Тогда, проводя аналогичные рассуждения, получаем, что при адиабатном сверхзвуковом течении газа для повышения скорости течения
становится положительным. Тогда, проводя аналогичные рассуждения, получаем, что при адиабатном сверхзвуковом течении газа для повышения скорости течения 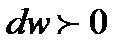 , нужно иметь расширяющийся канал с
, нужно иметь расширяющийся канал с 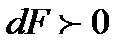 (при этом давление в потоке будет уменьшаться
(при этом давление в потоке будет уменьшаться  ). Любопытно, что для того чтобы получить сверхзвуковую скорость в сопле, после достижения критического сечения, в котором скорость течения газа сравнивается с местной скоростью звука, требуется производить расширение канала. Такой канал называется соплом Лаваля.
). Любопытно, что для того чтобы получить сверхзвуковую скорость в сопле, после достижения критического сечения, в котором скорость течения газа сравнивается с местной скоростью звука, требуется производить расширение канала. Такой канал называется соплом Лаваля.
В заключении к рассмотрению вопросов течения газов, воспроизведем без выводов некоторые полезные на практике зависимости. Итак, скорость газа в соплах можно определить из закона сохранения энергии с использованием энтальпии:
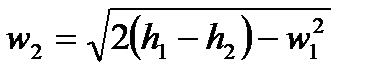
Как правило, скорость газа на входе в сопло мала настолько, что ею можно пренебречь и тогда:
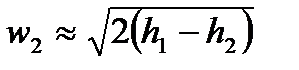
Вышеприведенное уравнение удобно для определения скорости газа в соплах при помощи h-s диаграмм. Из этого уравнения, используя ранее выведенные формулы для изменения энтальпии  , уравнения адиабаты
, уравнения адиабаты 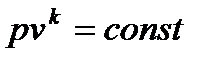 и закона Клапейрона, можно получить:
и закона Клапейрона, можно получить:
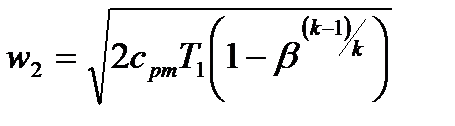
Здесь  . Если положить
. Если положить  , то:
, то:
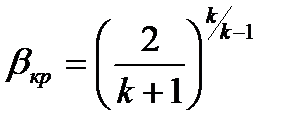
Как следует из рассуждений, если давление окружающей среды в которую истекает газ из сопла меньше или равно 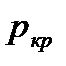 ,
,
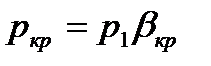
то скорость  будет звуковой и определится, как
будет звуковой и определится, как 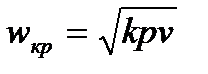 . При этом скорость на выходе из сопла не зависит от давления окружающей среды, так как в устье сопла устанавливается давление
. При этом скорость на выходе из сопла не зависит от давления окружающей среды, так как в устье сопла устанавливается давление  , отличающееся от давления окружающей среды. Это явление объясняется тем, что волна давления, распространяющаяся со скоростью звука, будет сноситься потоком и не достигать устья сопла.
, отличающееся от давления окружающей среды. Это явление объясняется тем, что волна давления, распространяющаяся со скоростью звука, будет сноситься потоком и не достигать устья сопла.
Массовый секундный расход газа определяется по уравнению для параметров в устье сопла:
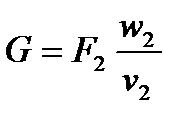
А так же
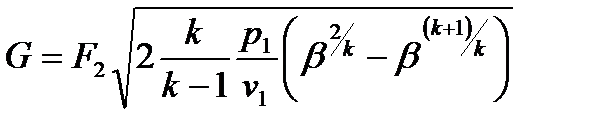
Расход газа в случае, если устанавливается критический режим течения газа с местной скоростью звука, при давлении окружающей среды менее 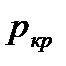 , не зависит от давления окружающей среды, так как
, не зависит от давления окружающей среды, так как 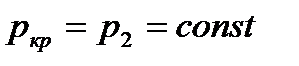 . Когда давление окружающей среды превышает
. Когда давление окружающей среды превышает  , то
, то  становится равным давлению окружающей среды, а расход – зависимым от давления окружающей среды.
становится равным давлению окружающей среды, а расход – зависимым от давления окружающей среды.
Течение реального газа в сопле всегда связано с трением газа о стенки, и внутренним вязкостным трением – т.е. с некоторыми потерями. По этой причине процесс не является обратимым, а для учета этого обстоятельства вводятся поправочные коэффициенты:
коэффициент скорости сопла 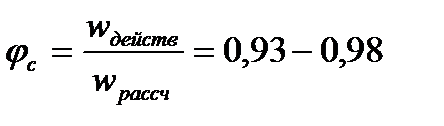
коэффициент расхода 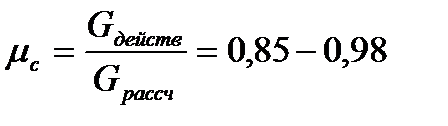
Приведенные коэффициенты зависят от качества обработки поверхности, размеров и пр.
Также в расчетах часто используются условные проходные сечения, 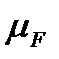 , например, для расчетов истечения топлива из форсунок.
, например, для расчетов истечения топлива из форсунок.
|
|
|


