 |
Билет 44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
|
|
|
|
Билет 12. Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
Атомы не имеют четких границ, поэтому абсолютное значение радиуса атома определить невозможно. Можно условно принять за радиус расстояние от ядра до максимума электронной плотности (орб радиус атома) или половину расстояния между центрами двух смежных атомов в кристаллах (эффективные радиусы атомов). Атомный радиус убывает по периоду (с увеличением заряда ядра), несколько увеличивается по группе (с увеличением количества орбиталей).
ЭИ – энергия, которую необходимо затратить, чтобы оторвать электрон от нейтрального атома и удалить его на бесконечно большое расстояние (эВ). Атом превращается в + ион. Потенциал ионизации – напряжение, которое необходимо приложить, чтобы оторвать электрон от атома. Существует несколько ионизирующих потенциалов (1-ый = энергии связи, 2-ой > энергии связи). Наиболее важный – 1 (Li 1 – 5,39 B; 2 – 75,62 B; 3 – 122,4 B). Скачкообразный характер потенциалов ионизации указывает на то, что электроны вокруг ядра расположены слоями. Чем больше ЭИ, тем более выражены неметаллические свойства элемента. ЭИ возрастает по периоду.
Энергия сродства к электрону – энергетический эффект присоединения электрона к атому (атом превращается в – ион). Чем больше ЭСЭ, тем ярче неметаллические свойства.
Электроотрицательность – количественная характеристика способности атома в молекуле притягивать к себе электроны. полусумма ЭСЭ и ЭИ (по Малликену). Полинг – ЭО – разность энергии диссоциации соединения AB и образующих его молекул АА и ВВ, ввел относительную шкалу, приняв ЭО фтора за 4. Чем больше электроотрицательность, тем легче его атомы превращаются в – ион. ЭО возрастает по периоду и уменьшается по группе.
|
|
|
Билет 44. Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
В отличие от предыдущего случая с ростом температуры р-римость уменьшается. Закон В. Генри. При постоянной температуре р-римость газа, выраженная в весовых единицах пропорциональна давлению газа над жидкостью.
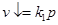 , где k-константа скорости растворения, p – давление газа над раствором.
, где k-константа скорости растворения, p – давление газа над раствором.
 , где k-константа скорости испарения, c – концентрация.
, где k-константа скорости испарения, c – концентрация.
При достижении равновесия 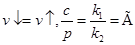 - константа Генри.
- константа Генри.
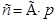 Концентрация пропорциональна давлению. Закон Сивертса:
Концентрация пропорциональна давлению. Закон Сивертса: 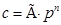 где n понижается с ростом температуры. Полностью закон Генри выполняется для идеальных газов, дающих в итоге идеальные р-ры.
где n понижается с ростом температуры. Полностью закон Генри выполняется для идеальных газов, дающих в итоге идеальные р-ры.
Закону Генри строго подчиняются только те газы, которые не взаимодействуют с р-рителем, их р-римость не велика. t=0, 100гр H2O р=1 атм, 0.335г CO2; р=2 атм, 0.67г CO2
С ростом давления увеличивается плотность газа, т.е. при р=2атм газ занимает тот же объем. Р-римость газа, выраженная в объемных ед. от объема не зависит (Объем. ед./100)
Закон Дальтона: При растворении смеси газов в жидкости р-римость каждого компонента пропорциональна его парциальному давлению. (Кислород в воде)
(кислород) t=20, 100мл Н2О, р=1атм, 3.1 мл O2
(воздух) t=20, 100мл Н2О, р=1атм, 0.62 мл O2
Законы Генри и Дальтона - следствия.
Закон распределения.
Если при постоянной температуре некоторое в-во распределяется между двумя соприкасающимися фазами, то отношение концентрации этого в-ва в соприкасающихся фазах есть величина постоянная, называется коэфф. растворения "L". Величина "L" не зависит от абс. кол-ва вводимого 3-го в-ва, а определяется природой фаз 1,2 и природой в-ва 3.
С/Р=Г
Закон распределения применяется в технике. (при экстракции стали из шлака)
Закон распределения используется при глубокой очистке полупроводниковых материалов (метод плавки по закону распределения)
|
|
|


