 |
Растворы твердых лекарственных веществ
|
|
|
|
Большинство твердых лекарственных веществ являются кристаллическими веществами. Процесс растворения кристаллического вещества состоит из двух одновременно протекающих процессов: сольватации (в данном случае гидратации) частиц и разрушения кристаллической решетки.
На рис.15G показан процесс растворения натрия хлорида (кристаллическое ионное соединение) в воде (полярная жидкость). Ионы натрия хлорида взаимодействуют с дипольными молекулами воды: к положительному иону Na+ диполи обращены своими отрицательными полюсами, а к отрицательным ионам С1 - положительными. Постепенно диполи воды проникают между нонами Na+ и С1 - в твердой фазе, отрывая их от кристалла.
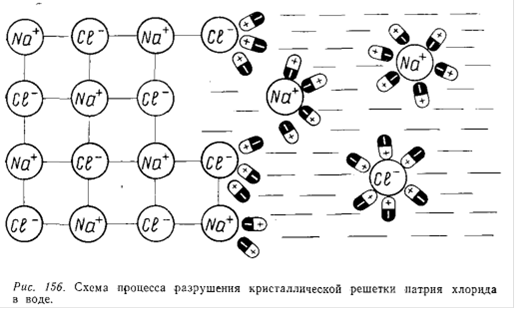
Для эффективности растворения важно, чтобы силы сцепления между молекулами растворителя и частицами растворяемого вещества были больше сил взаимного притяжения этих частиц между собой. Вода по сравнению с другими растворителями обладает огромной полярностью (самое высокое значение диэлектрической постоянной). Именно этим свойством обусловливаются высокая ионизирующая способность воды и ее разрушительное действие на кристаллические решетки многих полярных соединений.
При растворении веществ наблюдается поглощение или выделение теплоты. Поглощение теплоты указывает на затрату энергии. Объясняется это тем, что на перевод вещества из твердого состояния в жидкое, т.е. на разрушение кристаллической решетки, обязательно расходуется энергия. Например, ионы натрия и хло. ра до растворения натрия хлорида в воде фиксированы в узлах кристаллической решетки, обладая при этом только вращательными и колебательными движениями. После же растворения ионы получают возможность относительно свободно двигаться внутри раствора, для чего необходимо увеличение их кинетической энергии. Увеличение ее происходит за счет отнятия энергии у растворителя в форме тепла, в результате чего происходит охлаждение раствора. Чем прочнее кристаллическая решетка, тем значительнее охлаждение раствора.
|
|
|
Выделение тепла при растворении веществ всегда указывает на активно протекающую сольватацию, т.е. образование соединений между растворимым веществом и растворителем.
Конечный тепловой эффект растворения (Q) нужно рассматривать как сумму двух слагаемых - положительного теплового эффекта сольватации (q) и отрицательного теплового эффекта разрушения кристаллической решетки (-с):
= q + (- с).
Знак теплового эффекта растворения будет зависеть от того, какое слагаемое преобладает. Если кристаллическая решетка прочна, то слагаемое (-с) численно больше q;. в этом случае растворение вещества будет проходить с поглощением тепла. Наоборот, у веществ с непрочной кристаллической решеткой и сильно сольватируемых (гидратируе-мых) превалирует слагаемое q; при этом растворение будет проходить с выделением тепла. Часто положительный и отрицательный тепловые эффекты растворения оказываются одинаковыми или очень близкими друг к Другу; в таких случаях при растворении мы не замечаем охлаждения или разогревания раствора.
Тепловой эффект растворения относят к 1 молю вещества, растворяемому в достаточно большом количестве растворителя. С поглощением тепла растворяются KN03 [Q=-8,52 ккал/ (г-моль)], Ki (-5,11), NaCl (-1,2),. NaBr (-0, 19) и многие другие кристаллические вещества. С выделением тепла растворяются AgN03 [Q=+5,4 ккал/ (г-моль)], NaOH (+10,0) и некоторые другие вещества. При растворении 'Кристаллогидратов в воде наблюдается более низкий тепловой эффект, чем при растворении безводной соли. Например, теплота растворения безводно-то СаС12 равна +17,41 ккал/{г-моль), а СаС126Н20 составляет - 4,31 ккал/ (г-моль). Разница (+ 17,41) - (-4,31) =21,72 ккал представляет собой теплоту образования кристаллогидрата.
|
|
|
Твердые лекарственные препараты, входящие в состав раствора в суммарном количестве, не превышающем 5%, концентрированные растворы которых отсутствуют, растворяют в отмеренном количестве воды или другой жидкости. При определении общего объема микстуры количество твердых препаратов в данном случае в расчет не принимают, так как объем микстуры при их растворении увеличивается незначительно и не превышает норм отклонений, допустимых для лекарственных форм, приготовленных в аптеках.
При приготовлении растворов, содержащих 5 и более 5% сухих препаратов, используют концентрированные растворы этих препаратов. При отсутствии концентрированных растворов указанных препаратов микстуры приготовляют в мерной посуде или объем воды, требуемый для растворения сухих препаратов, определяют путем расчета. При расчете необходимо учитывать коэффициент увеличения объема, т.2. прирост объема раствора при растворении 1 г вещества.
Не допускается прибавление сухих препаратов в количествах 5% и более непосредственно в отмеренную жидкость, так как при этом изменение объема микстуры превышает допустимые нормы отклонений.
|
|
|


