 |
Уравнения состояния. Смеси жидкостей, паров и газов. Общие соотношения
|
|
|
|
Уравнения состояния
При относительно низком давлении и высоких температурах реальные газы имеют малую плотность и, с известным допущением, могут рассматриваться как газы идеальные.
Уравнение состояния идеального газа (Клапейрона (1834 г. ) для G кг и
для 1 кг соответственно
 ;
; 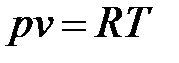 , (1. 21)
, (1. 21)
где  – характеристическая постоянная газа (Дж/(кг× К).
– характеристическая постоянная газа (Дж/(кг× К).
Газовые постоянные для различных тел определяются свойствами рабочих тел и поэтому имеют различные значения. Умножив на молекулярную массу ( 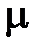 ) обе части уравнения (1. 21) получим уравнение Клапейрона – Менделеева
) обе части уравнения (1. 21) получим уравнение Клапейрона – Менделеева
для  =
=  кмолей газа
кмолей газа  (1. 22)
(1. 22)
или
для 1 кмоля газа  , (1. 23)
, (1. 23)
где  ( м3/ кмоль) – молярный объем, при нормальных физических условиях (P = 0, 1Мпа и t = 00C) равен
( м3/ кмоль) – молярный объем, при нормальных физических условиях (P = 0, 1Мпа и t = 00C) равен  22, 4 м3/ кмоль;
22, 4 м3/ кмоль;  Дж/(кмоль× К) – универсальная газовая постоянная.
Дж/(кмоль× К) – универсальная газовая постоянная. 

Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полуэмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения параметров их состояния.
Наиболее простым, качественно отображающим поведение реальных газов является уравнение состояния Ван-дер-Ваальса которое содержит две константы
P + a/v2)(v – b) = RT,  (1. 24)
(1. 24)
где a и b –экспериментально полученные константы; a /v2 – поправка на силы молекулярного сцепления; b – поправка на объем молекул.
В инженерных расчетах часто пользуются уравнением состояния идеального газа с введением в него поправочного коэффициента (z), называемого коэффициентом сжимаемости
|
|
|
 . (1. 25)
. (1. 25)
Коэффициент сжимаемости (z)учитывает различие между идеальным и реальными газами (для идеального газа z = 1).
Коэффициент сжимаемости является функцией давления, температуры и зависит от природы газа.
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулированный Ван-дер-Ваальсом. Принцип «соответственных» состояний утверждает, что критическое состояние действительно является одинаковым для всех веществ.
В критической точке для всех веществ r = 0,
 ,
, 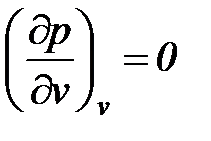 ,
, 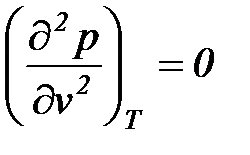 .
.
Вещества находятся в соответственных состояниях при одинаковом удалении от критической точки.
Степень удаления от критической точки определяется с помощью приведенных параметров:
· приведенного давления 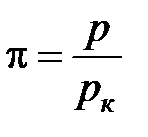 ;
;
· приведенной температуры 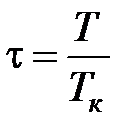 ;
;
· приведенного объема 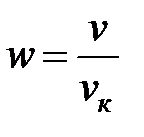 .
.
Уравнение состояния, записанное в виде F (  ) = 0, называется приведенным уравнением состояния. Оно не содержит индивидуальных констант вещества.
) = 0, называется приведенным уравнением состояния. Оно не содержит индивидуальных констант вещества.
Состояния вещества, в которых они имеют одинаковые  и
и 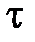 называются соответственными. Зная параметры
называются соответственными. Зная параметры  и
и 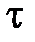 определяется коэффициент сжимаемости z.
определяется коэффициент сжимаемости z.
. Смеси жидкостей, паров и газов
Общие соотношения
Термодинамическая система – объект исследования термодинамики, может представлять собой смесь химически не взаимодействующих между собой чистых веществ. Предполагается также, что структура отдельных компонентов смеси в процессе смесеобразования и стабилизации смеси не изменяется.
Из закона сохранения материи следует, что масса смеси G равна сумме масс составляющих ее компонентов Gi
 , (1. 187)
, (1. 187)
а число киломолей смеси  равно сумме числа киломолей всех компонентов смеси
равно сумме числа киломолей всех компонентов смеси 
|
|
|
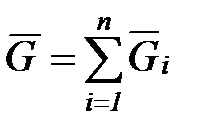 , (1. 188)
, (1. 188)
где 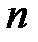 – число компонентов в смеси.
– число компонентов в смеси.
Одной из важнейших характеристик смеси является ее состав. Он задается массовыми или молярными концентрациями (долями) компонентов.
Массовой концентрацией или массовой долей mi называется отношение массы компонента к массе всей смеси
 . (1. 189)
. (1. 189)
Молярной концентрацией или молярной долей i-го компонента 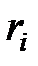 называется отношение количества киломолей этого компонента
называется отношение количества киломолей этого компонента  к общему числу киломолей смеси
к общему числу киломолей смеси
 . (1. 190)
. (1. 190)
Очевидно, что для термодинамических смесей справедливы следующие соотношения:
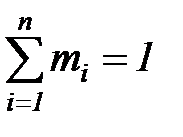 ,
,  . (1. 191)
. (1. 191)
Средняя (кажущаяся) молярная масса смеси 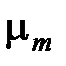 равна отношению массы смеси к количеству киломолей смеси и может быть определена из следующих соотношений:
равна отношению массы смеси к количеству киломолей смеси и может быть определена из следующих соотношений:
 =
= 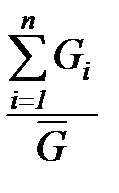 =
=  =
= 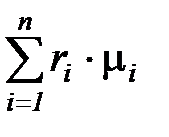 ; (1. 192)
; (1. 192)
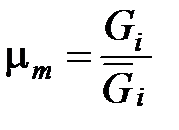 =
=  =
= 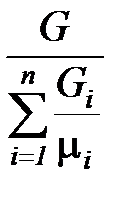 =
=  =
=  . (1. 193)
. (1. 193)
Зависимость между массовой и молярной концентрациями устанавливается соотношением
 =
= 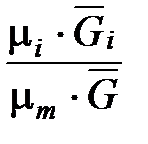 =
= 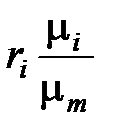 (1. 194)
(1. 194)
или
 . (1. 195)
. (1. 195)
Газовая постоянная смеси  может быть вычислена по следующему выражению:
может быть вычислена по следующему выражению:
 =
=  =
= 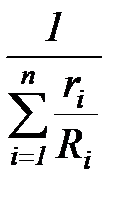 , (1. 196)
, (1. 196)
где  =8314 Дж/(кмоль К) – универсальная газовая постоянная, Ri – характеристическая газовая постоянная компонента смеси.
=8314 Дж/(кмоль К) – универсальная газовая постоянная, Ri – характеристическая газовая постоянная компонента смеси.
Для жидких, твердых и газообразных смесей часто используется и понятие объемной концентрации компонентов. Объемной концентрацией i-го компонента  называется отношение объема данного компонента Vi к объему всей смеси V
называется отношение объема данного компонента Vi к объему всей смеси V
 . (1. 197)
. (1. 197)
|
|
|


