 |
Бактериальные препараты, оказывающие положительное влияние на функцию кишечника
|
|
|
|
Пребиотики — продукты метаболизма нормальных микроорганизмов, способствующие повышению колонизационной резистентности собственной микрофлоры организма.
Пробиотики — жизнеспособные живые микроорганизмы (бактерии или дрожжи), которые оказывают положительный эффект на организм хозяина путем улучшения баланса микрофлоры кишечника (Gibson, 1995). Пробиотики могут содержать нормальные симбионты микрофлоры кишечника и самоэлиминирующиеся антагонисты дисбиозной микрофлоры.
Наиболее физиологичным при дисбиозе кишечника является назначение бактериальных препаратов (эубиотиков и пробиотиков) различных поколений:
• 1-е поколение — классические бактериальные препараты, состоящие из монокультур нормальной микрофлоры кишечника (бифидумбактерин, лактобактерин, колибактерин)
• 2-е поколение — препараты, представляющие продукты метаболизма микроорганизмов, в частности, молочной кислоты (хилак форте)
• 3-е поколение — самоэлиминирующиеся антагонисты (энтерол, аципол, биоспорин, споробактерии)
• 4-е поколение — комбинированные препараты, содержащие более одного вида пробиотических микроорганизмов (бификол, бифилонг, аципол, линекс, ацилакт)
• 5-е поколение — комплексные препараты, содержащие, кроме пробиотических микроорганизмов, дополнительные компоненты для усиления лечебно-профилактического эффекта (Бифи-форм®, Бифи-форм® Детский, содержащий бифидобактерии и лактобактерин в комплексе с витаминами группы В).
Бактериальные препараты можно назначать без предварительного проведения антибактериальной терапии или после нее с профилактической целью.
Назначение ферментных препаратов показано при дисбактериозе, сопровождающемся синдромом нарушения кишечного всасывания, а также при возникновении аллергических реакций.
|
|
|
Коррекция дисбактериоза в стадии компенсации (I степени)
■ Рациональное питание ребенка
Для детей первого года жизни оптимальным питанием является грудное молоко. При его отсутствии назначаются заменители грудного молока, обладающие иммуномодулирующими и гипоаллергенными свойствами («НАН1», «НАН2», «НАН гипоаллергенный» и др.), а также кисломолочные варианты адаптированных смесей («НАН кисломолочный» и др.).
Детям, получающим прикорм, кисломолочные неадаптированные смеси назначают с 7—8 мес. Для повышения антибиотической активности кисломолочных продуктов добавляют никотиновую кислоту (6—8 мг на 1 л), тиамина бромид (4—6 мг), токоферол (1—3 мг).
■ Назначение бактериальных препаратов (пребиотиков и пробиотиков), а также препаратов, улучшающих жизнедеятельность главной микрофлоры кишечника
Для достижения более стойкого клинико-бактериологического эффекта рекомендуют назначение кислотосодержащих препаратов, в состав которых не входят живые бактерии.
Хилак-форте — содержит продукты обмена бактерий и молочную кислоту. Назначают за неделю либо одновременно с пробиотиком. Детям в возрасте моложе 3-х мес назначают по 15—20 капель на прием, 3—12 мес — 20—30 капель, старше 1 года — по 20—40 капель, подросткам — 40—60 капель. Применяют 3 раза в день перед или во время еды с небольшим количеством жидкости, но не с молоком. При улучшении состояния дозу можно уменьшить в 2 раза. Длительность курса лечения от 2 нед до нескольких месяцев.
Дуфалак — назначают одновременно с бифидум-бактерином или бифидум-бактерином-форте: детям в возрасте до 1 года — 0,5 мл в сутки в 1 прием, утром натощак; 1—7 лет — по 10 мл 1 раз в сутки. При дисбиозе, протекающем с запором, доза составляет 0,5—1 мл/кг в сутки. Длительность курса лечения 3—4 нед.
|
|
|
При уменьшении количества бифидум-бактерий назначают бифидум-бактерин в виде порошка: детям в возрасте до 6 мес — 2,5 дозы на прием 2—3 раза в сутки (во время кормления, смешав с материнским молоком); при хорошей переносимости препарата через 3 сут его количество увеличивают до 5 доз на прием 2—3 раза в сутки или 2,5 дозы 5—6 раз в сутки. Детям старше 6 мес назначают 5 доз на
прием 2—3 раза в сутки (вместе с пищей или за 20 мин. до еды). Длительность курса лечения 3—4 нед. Число курсов 1—3.
Бифидум-бактерин-форте: детям в возрасте от 3 мес до 3 лет назначают по 2,5 дозы на прием 2—3 раза в сутки (во время кормления); при хорошей переносимости препарата через 3 сут его количество увеличивают до 5 доз на прием 2—3 раза в сутки. Детям старше 3 лет — 5 доз на прием 3 раза в сутки; при хорошей переносимости препарата через 3 сут всю суточную дозу можно (но не обязательно) давать в один прием. Длительность курса лечения 2—3 нед. Число курсов 1—3. Антибиотики в этот период не назначают.
Лактобактерии — препарат, устойчивый к антибиотикам. Назначают детям в возрасте до 6 мес по 1—2—3 дозы 2 раза в сутки за 30—40 мин до еды; при хорошей переносимости препарата через 3 сут дозу можно увеличить: по 3—5 доз 2 раза в сутки; детям старше 6 мес назначают вначале по 2—3 дозы 2 раза в сутки, при хорошей переносимости с 3-х суток — по 5 доз 2—3 раза в сутки. Длительность курса лечения 2—3 и 2—4 нед.
Бифи-форм®
В состав препарата входят бифидумбактерии и энтерококки, препарат помещен в кислотозащитную капсулу. При попадании в желудок капсула защищает лактобактерии от влияния желудочного сока в течение 4 ч при рН 1,2. В двенадцатиперстной кишке капсула растворяется, лактобактерии регидрируются и начинают размножаться благодаря специальной питательной среде, заложенной в капсуле. Два вида молочнокислых бактерий, входящих в состав препарата Бифи-форм®, способны угнетать рост патогенных микроорганизмов путем продукции антибактериальных субстанций, и в основном благодаря продукции молочной и уксусной кислот, что способствует снижению рН в кишечнике. Благодаря способности колонизировать кишечник лактобактерии являются естественными конкурентами за место в микробиоценозе и пищевой субстрат, они пассивно вытесняют патогенные микроорганизмы, восстанавливая нормальный баланс микрофлоры в кишечнике.
|
|
|
Назначают Бифи-форм® взрослым и детям в возрасте от 2 лет по 1 капсуле 2 раза в сутки, независимо от приема пищи. Дозу можно увеличивать до 4 капсул в сутки. Детям в возрасте от 2 до 6 мес назначают по 0,5 капсулы 2 раза в сутки, от 6 мес до 2 лет — по 1 капсуле 2 раза в сутки. Во избежание попадания капсулы в дыхательные пути при назначении препарата детям в возрасте от 2 мес до 2 лет капсулу раскрывают, и содержимое смешивают с едой.
Для улучшения состояния микробиоценоза кишечника и активизации противоинфекционных защитных реакций детям раннего возраста назначают препарат Бифи-форм® Детский (Ferrosan, Дания), в котором сочетаются Lactobacillus GG (LGG) и Bifidobacteria lactis (ВВ12). В состав препарата включены также тиамин ипиридоксин, дефицит которых сопровождает нарушение всасывания в кишечнике.
На кафедре педиатрии проведено клиническое постмаркетинговое исследование эффективности и переносимости препарата Бифи-форм® Детский, который назначали детям с дисбактериозом кишечника в стадии компенсации (группа риска) и субкомпенсации (антибиотикоассоциированный диарейный синдром) в возрасте от 6 мес до 2 лет. Под наблюдением находилось 40 детей.
Решение о введении в исследование детей в возрасте от 6 месяцев базируется на многочисленных зарубежных исследованиях подтверждающих безопасность применения препаратов содержащих LGG у детей с периода новорожденности, а также у недоношенных детей [7,8,9].
Бифи-форм® Детский назначали внутрь по 1 порошку 2 раза в сутки с небольшим количеством воды (1—2 столовых ложки) комнатной температуры или еды. Минимальный курс 10 сут — для детей группы риска и 14 сут — при наличии клинико-лабораторного синдрома дисбактериоза кишечника. Результаты, подтвержденные данными микробиологического исследования кала на дисбактериоз, свидетельствовали об эффективности препарата при дисбиотическом процессе как в стадии компенсации, так и субкомпенсации. Улучшение биоценоза кишечника обусловлено наличием в составе препарата бифидо- и лактофлоры, принадлежащей к видам, устойчивым в кислой среде желудка и к желчным кислотам, что позволяет применять незащищенные формы препарата (порошок), способные активно образовывать временные колонии в пищеварительном канале. Уменьшение количества патогенных микроорганизмов и УПМ по данным бактериологического исследования после терапии свидетельствует о достаточной антагонистической активности микроорганизмов, входящих в состав препарата. Нормализация стула и содержания витаминов (пиридоксина и тиамина) сопровождалась устранением аногенитального дерматита, мацерации и опрелостей в заднепроходной области. После исчезновения боли в животе и метеоризма улучшились общее состояние детей, сон и аппетит. У детей группы риска (дисбактериоз в стадии компенсации) оценивали состояние иммунной системы, поскольку при возникновении иммунодефицитного состояния всегда увеличивается угроза колонизации слизистых оболочек патогенной и условно патогенной микрофлорой. С другой стороны, нарушение нормального состава кишечной микрофлоры само по себе может быть причиной возникновения вторичного иммунодефицитного состояния.
|
|
|
После приеменения препарата Бифи-форм® Детский у пациентов отмечено улучшение показателей фагоцитоза, как количества клеток, осуществляющих данный механизм врожденного иммунитета, так и качественных характеристик их работы, в частности, завершенности фагоцитоза, способности к стимулированной активации, повышения активности пероксидазы лейкоцитов. Это позволяет сделать вывод об усилении первой линии защиты организма от инфекции, что особенно важно для детей раннего возраста, у которых специфичность иммунных реакций еще физиологически низка. Отмечено равномерное повышение исходно сниженных показателей клеточного иммунитета. Уменьшение количества активированных лимфоцитов CD25 как показателя хронического раздражающего действия инфекционных агентов свидетельствовало о снижении антигенной нагрузки на пациентов с дисбактериозом кишечника под влиянием пробиотика Бифи-форм® Детский. Подтверждением такого эффекта препарата является снижение уровня IgM (показателя остроты воспалительного процесса) в сыворотке крови детей после лечения. При этом возросла концентрация IgA, являющегося субстратом для образования секреторного IgA — основного защитного элемента слизистых оболочек увеличилась. Видимо, с увеличением содержания этого иммунного белка связано уменьшение количества патогенных и условно патогенных микроорганизмов.
|
|
|
2. Токсины бактерий, их природа, свойства, получение.
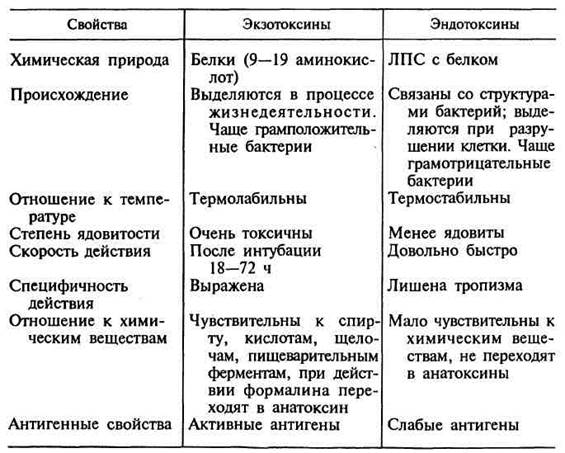
Важную роль в развитии инфекционного процесса играют токсины. По биологическим свойствам бактериальные токсины делятся на экзотоксины и эндотоксины.
Экзотоксины продуцируют как грамположительные, так и грамотрицательные бактерии. По своей химической структуре это белки. По механизму действия экзотоксина на клетку различают несколько типов: цитотоксины, мембранотоксины, функциональные блокаторы, эксфолианты и эритрогемины. Механизм действия белковых токсинов сводится к повреждению жизненно важных процессов в клетке: повышение проницаемости мембран, блокады синтеза белка и других биохимических процессов в клетке или нарушении взаимодействия и взаимокоординации между клетками. Экзотоксины являются сильными антигенами, которые и продуцируют образование в организме антитоксинов.
По молекулярной организации экзотоксины делятся на две группы:
• экзотоксины состоящие из двух фрагментов;
• экзотоксины, составляющие единую полипептидную цепь.
По степени связи с бактериальной клетки экзотоксины делятся условно на три класса.
• Класс А - токсины, секретируемые во внешнюю среду;
• Класс В - токсины частично секретируемые и частично связанные с микробной клеткой;
• Класс С - токсины, связанные и с микробной клеткой и попадающие в окружающую среду при разрушении клетки.
Экзотоксины обладают высокой токсичностью. Под воздействием формалина и температуры экзотоксины утрачивают свою токсичность, но сохраняют иммуногенное свойство. Такие токсины получили название анатоксины и применяются для профилактики заболевания столбняка, гангрены, ботулизма, дифтерии, а также используются в виде антигенов для иммунизации животных с целью получения анатоксических сывороток.
Эндотоксины по своей химической структуре являются липополисахаридами, которые содержатся в клеточной стенке грамотрицательных бактерий и выделяются в окружающую среду при лизисе бактерий. Эндотоксины не обладают специфичностью, термостабильны, менее токсичны, обладают слабой иммуногенностью. При поступлении в организм больших доз эндотоксины угнетают фагоцитоз, гранулоцитоз, моноцитоз, увеличивают проницаемость капилляров, оказывают разрушающее действие на клетки. Микробные липополисахариды разрушают лейкоциты крови, вызывают дегрануляцию тучных клеток с выделением вазодилататоров, активируют фактор Хагемана, что приводит к лейкопении, гипертермии, гипотонии, ацидозу, дессиминированной внутрисосудистой коагуляции (ДВК).
Эндотоксины стимулируют синтез интерферонов, активируют систему комплемента по классическому пути, обладают аллергическими свойствами.
При введении небольших доз эндотоксина повышается резистентность организма, усиливается фагоцитоз, стимулируются В-лимфоциты. Сыворотка животного иммунизированного эндотоксином обладает слабой антитоксической активностью и не нейтрализует эндотоксин.
Патогенность бактерий контролируется тремя типами генов: гены - собственной хромосомами, гены привнесенные плазмидами умеренными фагами.
3. Возбудитель туляремии. Таксономия. Характеристика. Микробиологическая диагностика. Специфическая профилактика и лечение.
Таксономия: отдел Gracilicutes, род Francisella. Возбудитель – Francisella tularensis.
Морфология: мелкие кокковидные полиморфные палочки, неподвижные, грамотрицательные, не образующие спор, могут образовывать капсулу.
Культуральные свойства: Факультативный аэроб, оптим. температура+37С. На простые питательных средах не растет. Культивируется на желточных средах, на средах с добавлением крови и цистеина. Рост медленный. Образуют мелкие колонии, круглые с ровным краем, выпуклые, блестящие.
Биохимические свойства: слабо ферментируют до кислоты без газа глюкозу, мальтозу, левулезу, маннозу, образуют сероводород. Туляремийный микроб по вирулентности разделен на подвиды: голарктическую (не ферментирует глицерин, цитруллин), неарктическую (ферментирует глицерин, не ферментирует цитруллин; среднеазиатскую (ферментирует глицерин и цитруллин, мало вирулентен).
Антигенные свойства: Содержит соматический О-и поверхностный Vi- антигены. Имеют антигенную близость с бруцеллами. В R- форме теряют Vi- антиген, а вместе с ним вирулентность и иммуногенность.
Факторы патогенности: неарктический подвид – высокая патогенность для человека при кожном заражении, голарктический и среднеазиатский подвиды – умеренно патогенны. Вирулентными являются S-формы колоний. Патогенные свойства связаны с оболоченным антигенным комплексом и токсическими веществами типа эндотоксина. Вирулентность обусловлена:капсулой, угнетающей фагоцитоз; нейраминидазой, способствующей адгезии; эндотоксином (интоксикация); аллергенными свойствами клеточной стенки;
Эпидемиология: природно-очаговое заболевание. Источник инфекции – грызуны. Множественность механизмов передачи. Передача возбудителя через клещей, комаров. Человек заражается контактным, алиментарным, трансмиссивными путями.
Резистентность: в окружающей среде сохраняется долго, нестоек к высокой температуре, чувствителен к антибиотикам (тетрациклин, левомицетин).
Патогенез: На месте внедрения возбудителя (кожа, слизистые оболочки глаз, дыхательных путей, желудочно-кишечного тракта) развивается первичный воспалительный очаг, откуда возбудитель распространяется по лимфатическим сосудам и узлам, поражая их с образованием первичных бубонов; в различных органах формируются гранулемы. Микроб и его токсины проникают в кровь, что приводит к бактериемии и генерализации процесса, метастазированию и развитию вторичных туляремийных бубонов.
Клиника. Инкубационный период 3—7 дней. Болезнь начинается остро, внезапно с повышения температуры тела. Различают бубонную, язвенно-бубонную, глазо-бубонную, абдоминальную, легочную и генерализованную(септическую) клинические формы туляремии.
Иммунитет. После перенесенной инфекции иммунитет сохраняется длительно, иногда пожизненно; развивается аллергизация организма к антигенам возбудителя.
Микробиологическая диагностика:
Бактериоскопическое исследование: Из исследуемого материала готовят мазки, окрашивают по Грамму. В чистой культуре - мелкие кокки. В мазках из органов преобладают палочковидные формы. Спор не образуют, грамотрицательные, иногда выражена биполярная окраска.
Бактериологическое исследование и биопроба. Применяются для выделения чистой культуры бактерий туляремии. Наиболее чувствительными животными являются мыши и морские свинки, которые погибают даже при подкожном введении единичных бактерий. Выделение бактерий туляремии проводят на свернутой яично-желточной среде, глюкозоцистиновом кровяном агаре. Вирулентные штаммы образуют S-формы колоний—мелкие, гладкие, беловатого цвета с голубоватым оттенком.
Идентификацию чистой культуры проводят по морфологии бактериальных клеток, характеру роста, биохимическим и антигенным свойствам. Биохимические свойства этих бактерий выявляются на специальной плотной среде с ограниченным содержанием белка. Бактерии туляремии содержат оболочечный антиген, с которым связаны их вирулентные и иммуногенные свойства, и О-соматический антиген. По антигенным свойствам близки к бруцеллам.
Серодиагностика. Ставится реакция агглютинации с туляремийным диагностикумом. Относительно позднее появление агглютининов в крови (на 2-й неделе болезни) затрудняет применение этой реакции для ранней диагностики, однако их длительное сохранение делает возможной ретроспективную диагностику. Обязательно прослеживается нарастание титра агглютинации. Наиболее чувствительным методом серодиагностики туляремии является РПГА.
Для экспресс-диагностики применяется кровяно-капельная реакция: кровь из пальца наносят на стекло, добавляют каплю дистиллированной воды (для лизиса эритроцитов), вносят каплю диагностикума и смешивают стеклянной палочкой. При наличии в крови агглютининов в диагностическом титре (1:100 и выше) в капле немедленно наступает агглютинация диагностикума; при титрах ниже диагностических агглютинация происходит через 2—3 мин.
Кожно-аллергическая проба. Выпускаются два вида тулярина: для внутрикожной пробы и для надкожной. Проба высокочувствительна и дает положительные результаты у больных, начиная с 3—5-го дня болезни, но также и у переболевших и вакцинированных, поэтому оценка реакции должна проводиться с осторожностью.
Лечение: антибиотики стрептомицинового и тетрациклинового ряда. В случае затяжного течения – комбинированная антибиотикотерапия с использованием убитой лечебной сыворотки.
Профилактика: с пецифическая профилактика - применяют живую туляремийную вакцину. Иммунитет длительный, проверяется с помощью пробы с тулярином.
Туляремийный диагностикум – взвесь убитых бактерий туляремии, применяется в случае постановки реакции агглютинации при серодиагностике.
Тулярин – взвесь туляремийных бактерий (вакцинного штамма), убитых нагреванием, для постановки кожно-аллергической пробы.
Туляремийная живая сухая накожная вакцина – высушенная живая культура вакцинного штамма, для профилактики.
Билет36
1. Особенности проявления кожно-аллергических проб у детей раннего возраста Их значение в оценке диагностических реакций
Аллергические пробы - биологические реакции для диагностики ряда заболеваний, основанные на повышенной чувствительности организма, вызванной аллергеном.При многих инфекционных заболеваниях за счет активации клеточного иммунитета развивается повышенная чувствительность организма к возбудителям и продуктам их жизнедеятельности. На этом основаны аллергические пробы, используемые для диагностики бактериальных, вирусных, протозойных инфекций, микозов и гельминтозов. Аллергические пробы обладают специфичностью, но нередко они бывают положительными у переболевших и привитых.Все аллергические пробы подразделяют на две группы — пробы invivo и invitro. К первой группе ( invivo) относятся кожные пробы, осуществляемые непосредственно на пациенте и выявляющие аллергию немедленного (через 20 мин) и замедленного (через 24 — 48 ч) типов.Аллергические пробы invitro основаны на выявлении сенсибилизации вне организма больного. Их применяют тогда, когда по тем или иным причинам нельзя произвести кожные пробы, либо в тех случаях, когда кожные реакции дают неясные результаты.Для проведения аллергических проб используют аллергены — диагностические препараты, предназначенные для выявления специфической сенсибилизации организма. Инфекционные аллергены, используемые в диагностике инфекционных заболеваний, представляют собой очищенные фильтраты бульонных культур, реже взвеси убитых микроорганизмов или АГ, выделенные из них.Кожные пробы. Инфекционные аллергены вводят, как правило, внутрикожно или накожно, путем втирания в скарифицированные участки кожи. При внутрикожном способе в среднюю треть передней поверхности предплечья специальной тонкой иглой вводят 0,1 мл аллергена. Через 28 — 48 ч оценивают результаты реакции ГЗТ, определяя на месте введения размеры папулы.Неинфекционные аллергены (пыльца растений, бытовая пыль, пищевые продукты, лекарственные и химические препараты) вводят в кожу уколом (прик-тест), накожно путем скарификации и втирания или внутрикожной инъекцией разведенного раствора аллергена. В качестве отрицательного контроля используют ИХН, в качестве положительного — раствор гистамина. Результаты учитывают в течение 20 мин (ГНТ) по величине папулы (иногда до 20 мм в диаметре), наличию отека и зуда. Внутрикожные пробы ставят в случае отрицательного или сомнительного результата прик-теста. По сравнению с последним, дозу аллергена уменьшают в 100-5000 раз.Кожные пробы на наличие ГЗТ широко применяют для выявления инфицированности людей микобактериями туберкулеза (проба Манту), возбудителями бруцеллеза (проба Бюрне), лепры (реакция Митсуды), туляремии, сапа, актиномикоза, дерматомикозов, токсоплазмоза, некоторых гельминтозов и др. Пробы invitro. Эти методы исследования безопасны для больного, достаточно чувствительны, позволяют количественно оценить уровень аллергизации организма.В настоящее время разработаны тесты для определения сенсибилизации, основанные на реакциях Т- и B-лимфоцитов, тканевых базофилов, выявлении общих специфических IgE в сыворотке крови и др. К ним относятся реакции торможения миграции лейкоцитов и бласттрансформации лимфоцитов, специфическое розеткообразование, базофильный тест Шелли, реакция дегрануляции тканевых базофилов, а также аллергосорбентные методы (определение специфических IgE в сыворотке крови). Реакция торможения миграции лейкоцитов (РТМЛ). РТМЛ основана на подавлении миграции моноцитов и других лейкоцитов под действием медиаторов, вырабатываемых сенсибилизированными лимфоцитами, в присутствии специфического аллергена. Реакция бласттрансформации лимфоцитов (РБТ). В основе этой реакции лежит способность нормальных лимфоцитов периферической крови вступать в митоз и превращаться в бластные формы при культивировании их invitro под действием специфических факторов — аллергенов и неспецифических стимуляторов митогенеза — митогенов (фитогемагглютинин, конканавалин А, липополисахариды и другие вещества). Реакция специфического розеткообразования. Розетки — характерные образования, возникающие invitro в результате прилипания эритроцитов к поверхности иммунокомпетентных клеток. Розеткообразование может происходить спонтанно, поскольку Т-лимфоциты человека содержат рецепторы к эритроцитам барана. Спонтанное розеткообразование здоровых людей составляет 52 — 53% и служит показателем функционального состояния Т-лимфоцитов. Этот феномен воспроизводится также и в том случае, если используют эритроциты, на которых фиксированы соответствующие аллергены. Реакция дегрануляции тканевых базофилов. Методика основана на том, что под действием аллергена происходит дегрануляция тканевых базофилов крысы, предварительно сенсибилизированных цитофильными AT из сыворотки крови больного. Базофильный тест Шелли. Известно, что базофильные гранулоциты человека или кролика также дегранулируются в присутствии сыворотки больного и аллергена, к которому чувствителен данный пациент. Определение антител класса IgEinvitro. Лабораторная диагностика заболеваний, в основе которых лежит ГНТ, основана на определении аллергенспецифических IgEанти-IgE. При использовании радиоактивной метки метод носит название радиоаллергосорбентного теста (PACT), но чаще в качестве метки используют фермент или флюоресцирующее вещество (ФАСТ). Время анализа — 6 — 7 часов. Принцип метода: фиксированный на твердой основе известный аллерген инкубируют с сывороткой крови больного; находящиеся в сыворотке специфические IgEанти-IgE связываются с аллергеном и, таким образом, остаются фиксированными на основе и могут вступать в специфическое взаимодействие с добавляемыми мечеными анти- IgE.
2. Санитарно-микробиологическое исследование почвы. Микробное число, коли-титр, перфрингенс-титр почвы.
Общее микробное число определяют глубинным посевом (на плотной среде) Перфрингенс-титр почвы - минимальное количество почвы, в котором еще определяются Clostridium perfringens. При фекальном загрязнении почвы клостридии обнаруживают в титре 0,01 г. Определяют перфрингенс-титр глубинным посевом.
Оценка фекального заражения проводится по индексу БГКП – коли-титр(количество БГКП в 1 г почвы).
На свежее фекальное загрязнение указывают: обнаружение энтерококков, большое количество БГКП при отсутствии нитрифицирующих бактерий, относительно высокое содержание вегетативных форм клостридий.
Титр БГКП и перфрингенс-титр для сильно загрязненных почв – 0,009; для чистых почв – коли-титр 1,0; перфрингенс-титр – 0,01.
3. Возбудители кишечного иерсиниоза. Таксономия. Характеристика. Микробиологическая диагностика. Лечение.
Кишечный иерсиниоз — острая инфекционная болезнь, характеризующаяся поражением ЖКТ, тенденцией к генерализации с различных органов и систем.
Возбудитель кишечного иерсиниоза Yersinia enterocolitica.
Таксономия. Y.enterocolitica относится к отделу Gracilicutes, семейству Enterobacteriaceae, роду Yersinia.
Морфологические и тинкториальные свойства. Возбудитель полиморфен: он может иметь форму либо палочки с закругленными концами, либо овоидную с биполярным окрашиванием. Спор не имеет, иногда образует капсулу. Перитрих есть. Некоторые штаммы имеют пили. Грамотрицателен.
Культуральные свойства. Y.enterocolitica — факультативный анаэроб. Наиб. благоприятная темп. 25С. Возбудитель неприхотлив и растет на простых питательных средах.
Биохимическая активность. Биохимическая активность возбудителя высокая. Внутри вида по спектру б/х активности: индолообразованию, утилизации эскулина, реакции Фогеса – Проскауэра подразделяются на 5 хемоваров.
Основные б/х признаки: расщепление мочевины, ферментация сахарозы, отсутствие ферментации рамнозы, продукция орнитиндекарбоксилазы.
Антигенная структура. О- и Н-антигены, у некоторых штаммов обнаружен К-антиген. По 0-антигену различают более 30 серогрупп, из которых от больных чаще всего выделяют представителей серогрупп 03, 09, 05.
Факторы патогенности. Образует термостабильный эндотоксин. Некоторые штаммы выделяют вещество, соответствующее экзотоксину и обладающее энтеро- и цитотоксическим действием. У иерсиний обнаружены также инвазивный белок и белки, препятствующие фагоцитозу. Адгезивная активность иерсиний связана с пилями и белками наружной мембраны.
Резистентность. Чувствителен к высокой температуре, солнечным лучам, дезинфицирующим веществам, но очень устойчив к действию низких температур: хорошо переносит температуру -20 °С.
Эпидемиология. Источники болезни для человека - крысы, мыши, животные и птицы,. Механизм заражения иерсиниозом фекально-оральный, основным путем передачи является алиментарный: болезнь может возникнуть при употреблении фруктов, овощей, молока, мяса. Но возможны также контактный (при контакте людей с больными животными) и водный пути передачи.
Патогенез. Возбудитель попадает в организм через рот, в нижних отделах тонкой кишки прикрепляется к эпителию слизистой оболочки, внедряется в клетки эпителия, вызывая воспаление. Под действием токсинов усиливается перистальтика кишечника и возникает диарея. Иногда в патологический процесс вовлекается аппендикс, развивается аппендицит. Незавершенный фагоцитоз способствует генерализации процесса. У людей со сниженным иммунитетом могут развиться сепсис с образованием вторичных гнойных очагов в мозге, печени и селезенке.
Клиника. Различают гастроэнтероколитическую, аппендикулярную и септическую формы. Инкубационный период составляет от 1 до 4 дней. Болезнь начинается остро с повышения температуры тела до 39С, общей интоксикации, рвоты, болей в животе, поноса. Течение продолжительное.
Микробиологическая диагностика. Используют бактериологический и серологический методы исследования. Цель бактериологического метода являются идентификация возбудителя, определение антибиотикограммы, внутривидовая идентификация (установление серовара, биохимического варианта, фаговара).Материалом для бактериологического метода исследования служат испражнения, ликвор, кровь, моча, иногда червеобразный отросток. Материал для исследования помешают в фосфатный буфер и подвергают холодовому обогащению. Серологическая диагностика проводится постановкой РНГА, с диагностическим титром 1:160. Важное диагностическое значение имеет наблюдение за нарастанием титра антител в динамике.
Лечение. Этиотропная антибиотикотерапия.
Билет37
|
|
|


