 |
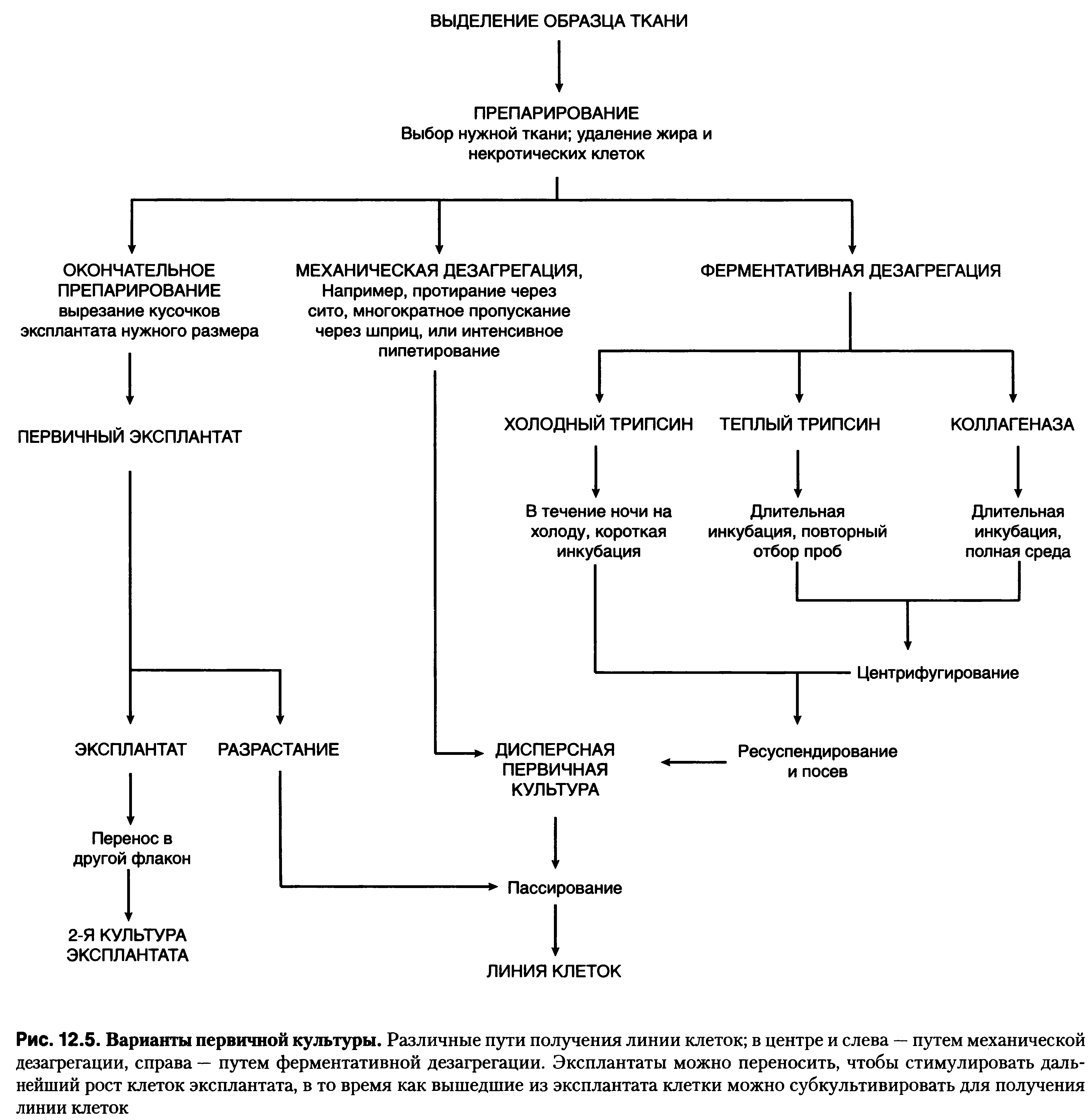
Дезагрегация (механическая или ферментативная).
|
|
|
|
Первичные эксплантаты применяются, когда доступны лишь очень малые количества ткани; ферментативная дезагрегация является предпочтительной, когда имеются в наличии большие объемы ткани. Механическую дезагрегацию используют, когда количество жизнеспособных клеток на выходе не является существенным.
А) Первичный эксплантат.
 Метод первичного эксплантата был первым методом получения культуры ткани. В оригинальном варианте фрагмент ткани погружали в плазму крови или лимфу, смешивали с гетерологичной сывороткой и эмбриональным экстрактом и помещали на покровное стекло, переворачивали и заключали в часовое стекло.
Метод первичного эксплантата был первым методом получения культуры ткани. В оригинальном варианте фрагмент ткани погружали в плазму крови или лимфу, смешивали с гетерологичной сывороткой и эмбриональным экстрактом и помещали на покровное стекло, переворачивали и заключали в часовое стекло.
Комок плазмы удерживал ткань на месте, и эксплантат можно было рассматривать с помощью обычного микроскопа. Гетерологичная сыворотка индуцировала сворачивание плазмы, эмбриональный экстракт, сыворотка и плазма снабжали клетки питательными веществами и факторами роста и стимулировали миграцию клеток из эксплантата. Эта методика используется до сих пор, но, по большей части, заменена упрощенным методом.
Этот метод особенно полезен при работе с небольшими количествами ткани, например при биопсии кожи, когда есть риск потери клеток в ходе механической или ферментативной дезагрегации. Недостатки- низкая адгезивность некоторых тканей и селекция клеток в процессе роста.
Б) Ферментативная дезагрегация.
Ферменты - неочищенные препараты трипсина, коллагеназа, эластаза, проназа, диспаза, ДНКаза и гиалуронидаза (по отдельности или в различных комбинациях). Ферменты не животного происхождения - Trypzean (Sigma) — рекомбинантный кукурузный трипсин, TrypLE (Invitrogen) — рекомбинантный трипсин, также подходят для первичной дезагрегации. Препараты грубой очистки более эффективны, чем очищенные ферментные препараты, так как первые содержат примеси других протеаз, хотя последние обычно менее токсичны и их действие более специфично. Трипсин и проназа дают более полную дезагрегацию, но могут повреждать клетки. С другой стороны, коллагеназа и диспаза дезагрегируют клетки неполностью, но менее токсичны.
|
|
|
Чаще всего для дезагрегации тканей используется трипсин грубой очистки, так как он довольно хорошо переносится многими клетками и эффективен в отношении многих тканей. Остаточная протеазная активность, остающаяся после промывания, нейтрализуется сывороткой культуральной среды или, в случае использования бессывороточной среды, ингибитором трипсина (например, ингибитор трипсина из сои).
- Теплый трипсин
 Недостаток - повреждение тканей. Поэтому после каждых 30 мин инкубации в теплом трипсине необходимо отбирать диссоциировавшиеся клетки, хотя для полной дезагрегации ткани требуется 3-4 ч, трипсин должен быть удален центрифугированием и нейтрализован сывороткой среды.
Недостаток - повреждение тканей. Поэтому после каждых 30 мин инкубации в теплом трипсине необходимо отбирать диссоциировавшиеся клетки, хотя для полной дезагрегации ткани требуется 3-4 ч, трипсин должен быть удален центрифугированием и нейтрализован сывороткой среды.
Этот метод полезен для дезагрегации больших количеств ткани за относительно короткое время. Метод плохо подходит для дезагрегации тканей взрослых организмов, которые содержат много фиброзной соединительной ткани, и некоторых чувствительных типов клеток (эпителий), которые могут быть повреждены при механическом перемешивании. Если после центрифугирования и ресуспендирования будет наблюдаться реагрегация клеток, их необходимо проинкубировать в течение 10-20 мин с ДНКазой (10-20 мкг/мл) и повторно отцентрифугировать.

- Трипсинизация с преинкубацией на холоду
Более простым методом, который позволяет минимизировать повреждения клеток в течение инкубации, является погружение ткани в трипсин, охлажденный до 4 °С, и инкубация в течение 6-18 ч для более полного проникновения фермента в ткань. В этих условиях протеолитическая активность трипсина низка. После этой процедуры требуется только 20-30 мин инкубировать ткань при 37 °С для дезагрегации.
|
|
|
Метод холодной трипсинизации обычно дает более высокий выход жизнеспособных клеток и повышает их выживаемость после 24 ч культивирования. Метод холодной трипсинизации также удобен тем, что не требуется ни перемешивания, ни центрифугирования и инкубацию при 4 °С можно проводить в течение ночи.
В случаях, когда трипсин малоэффективен (сильно волокнистые ткани) или травматичен (эпителий) для клеток, используют другие ферменты. Так как внеклеточный матрикс часто содержит коллаген, особенно в соединительной ткани и мышцах, очевидным выбором является коллагеназа. Также используются другие бактериальные протеазы, такие как проназа и диспаза. Так как в процессах межклеточной адгезии участвуют углеводы, то в сочетании с коллагеназой используют гиалуронидазу и нейраминидазу.
В) Механическая дезагрегация
Выход клеток из первичного эксплантата - медленный процесс. Ферментативное расщепление требует больше усилий и имеется риск протеолитического повреждения клеток во время обработки ферментами.
Альтернативный метод - механическая дезагрегация (измельчение ткани; продавливание ткани через серию клеточных сит с постепенным уменьшением размера ячеек; пропускание фрагментов ткани через шприц; многократное пипетирование). В результате клеточная суспензия получается быстрее, чем при ферментативном расщеплении, но при этом могут возникать механические повреждения.
Эта методика применима только для мягких тканей (селезенка, эмбриональная печень, взрослый мозг и некоторые мягкие опухоли человека и животных). Даже для тканей мозга, для которых легко достигается полная дезагрегация, выживаемость полученных при механической дезагрегации клеток ниже, чем при ферментативной дезагрегации, хотя затраты времени значительно меньше. Когда количество ткани достаточно велико, а эффективность выхода не имеет значения, с помощью механической дезагрегации можно выделить за короткое время столько же клеток, сколько и при ферментативном расщеплении, но для этого понадобится гораздо больше ткани.
|
|
|
Каткая схема.
После извлечения клеток из ткани или из организма и помещения их в культуру питательная среда должна обеспечивать все внешние условия, которые клетки имели in vivo (питательными и гормональными факторами, а также факторами стромы). Только в этом случае возможно выживание клеток, их пролиферация и дифференцировка. Наиболее распространенными питательными средами являются среда Игла (MEM – minimal essential medium), среда Дульбекко (DMEM – Dullbecco’s modified Eagle’s medium) и среда RPMI-1640 (Roswell Park 5 Memorial Institute).
Большинство клеточных культур размножаются в форме монослоя, прикрепившись к стеклу или пластиковому субстрату (мезенхимные стромальные клетки костного мозга; стволовые клетки паренхиматозных органов; резидентные стволовые клетки жировой ткани, кожи, мышц, соединительной ткани, мезенхимальные стволовые клетки пуповины и плаценты). Некоторые культуры, главным образом трансформированные клетки, кроветворные клетки и асцитные опухоли, могут размножаться в суспензии.
Согласно N 180-ФЗ "О биомедицинских клеточных продуктах" для приготовления клеточной линии используются исключительно клетки человека или человека, в отношении которого констатирована смерть в порядке, установленном законодательством Российской Федерации.
|
|
|


