 |
II . Комплексные соединения
|
|
|
|
II.1. Понятие и определение.
Комплексные соединения – наиболее многочисленный класс неорганических соединений. Дать краткое и исчерпывающее определение этим соединениям трудно. Комплексные соединения также называют координационными. В химии координационных соединений переплетаются органическая и неорганическая химия.
До конца XIX века изучение комплексных соединений носило чисто описательный характер. 1893 год швейцарский химик Альфред Вернер создал координационную теорию. Суть ее заключается в следующем: в комплексных соединениях имеется правильное геометрическое размещение атомов или групп атомов, называемых лигандами или аддендами, вокруг центрального атома – комплексообразователя.
Таким образом, химия комплексных соединений изучает ионы и молекулы, состоящие из центральной частицы и координированных вокруг нее лигандов. Центральная частица – комплексообразователь и непосредственно связанные с ней лиганды, образуют внутреннюю сферу комплекса. Для неорганических лигандов, чаще всего, число их совпадает с координационным числом центральной частицы. Таким образом, координационное число – это общее число нейтральных молекул или ионов (лигандов), связанных с центральным атомом в комплексе
Ионы, находящиеся за пределами внутренней сферы, образуют внешнюю сферу, комплексного соединения. В формулах внутреннюю сферу заключают в квадратные скобки.
лиганды
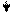
K4 [Fe(CN)6] [Fe(CN)6]4- - внутренняя сфера или комплексный ион


ион-комплексообразователь координационное
число
Комплексообразователями служат:
|
|
|
1) положительные ионы металлов (чаще d-элементы): Ag+, Fe2+, , Fe3+, Cu2+, Al3+, Co3+; и др. (ионы- комплексообразователи).
2) реже - нейтральные атомы металлов, относящиеся к d-элементам: (Сo, Fe, Mn и др.)
3) некоторые атомы неметаллов с различной положительной степенью окисления - B+3, Si+4, P+5 и др.
Лигандами могут быть:
1) отрицательнозаряженные ионы (OH-, Hal -, CN - -цианогруппа, SCN- - тиоцианогруппа, NH2- -аминогруппа, и др.)
2) полярные молекулы: H2O (название лиганда - «аква»), NH3 («аммин»),
CO («карбонил»).
Таким образом, комплексными соединениями (координационными соединениями) называются сложные химические соединения, в составе которых имеются комплексные ионы, образованные центральным атомом в определенной степени окисления (или с определенной валентностью) и связанными с ним лигандами.
II.2. Классификация
I. По характеру лигандов:
1. Аквакомплексы (H2O)
2. Гидроксокомплексы (OH)
3. Амминкомплексы (NH3) - аммиакаты
4. Ацидокомплексы (с кислотными остатками - Сl-, SCN-, S2O32- и другие)
5. Карбонилкомплексы (СО)
6. Комплексы с органическими лигандами (NH2-CH2-CH2-NH2 и др.)
7. Анионгалогенаты (Na [I Cl4])
8. Аминокомплексы (NH2)
II. По заряду комплексного иона:
1. Катионного типа - заряд комплексного иона - положительный
2. Анионного типа - заряд комплексного иона - отрицательный.
Для правильного написания комплексного соединения необходимо знать степень окисления центрального атома, его координациооное число, природу лигандов и заряд комплексного иона.
II.3. Координационное число можно определить как число σ - связей между нейтральными молекулами или ионами (лигандами) и центральным атомом в комплексе.
Величина координационного числа определяется, главным образом, размерами, зарядом и строением электронной оболочки комплексообразователя. Наиболее часто встречается координационное число 6. Оно характерно для следующих ионов: Fe2+, Fe3+, Co3+, Ni3+, Pt4+, Al3+, Cr3+, Mn2+, Sn4+.
|
|
|
K3[Fe(CN)6], Na3[Co(NO2)6], [Cr(H2O)6] Cl3
гексацианоферрат (Ш) гексанитрокобальтат(Ш) гексааквахрома (Ш)хлорид
калия натрия
Координационное число 4 встречается у 2-хзарядных ионов и у алюминия или золота: Hg2+, Cu2+, Pb2+, Pt 2+, Au3+ , Al3+.
[Cu(NH3)4] (OH)2 - тетрааммин меди(II) гидроксид;
Na2[Cu(OH)4 ] – тетрагидроксокупрат (II) натрия
K2 [HgI4] – тетраиодомеркурат (II) калия;
H[AuCl4] – тетрахлороаурат(III) водорода.
Часто координациооное число определяется как удвоенная степень окисления иона-комплексообразователя: у Hg2+, Cu2+, Pb2+ - координационное число равно 4; у Ag+, Cu+ - координационное число равно 2.
Для определения, расположения иоов во внутренней или внешней сфере нужно провести качественные реакции. Например, у K3[Fe(CN)6] -гексацианоферрата(III) калия. Известно, что ион железа (+3) образует с роданид (тиоционат)- анионом роданид железа (+3) темно-красного цвета.
Fe3+ +3 NH4 SCN à Fe (SCN)3 + 3NH4+
При добавлении раствора роданида аммония или калия к раствору гексацианоферрата(III) калия окраски не наблюдается. Это говорит об отсeтствии ионов железа Fe3+ в растворе в достаточном количестве. Центральный атом связан с лигандами ковалентной полярной связью (донорно-акцепторный механизм образования связи), поэтому реакция ионного обмена не идет. Наоборот, внешняя и внутренняя сферы связаны ионной связью.
II.4. Строение комплексного иона с точки зрения электронного строения комплексообразователя.
Разберем строение катиона тетраамминмеди (II):
а) электронная формула атома меди:






 29Сu +29))))
29Сu +29))))
2 8 18 1 ↑↓ ↑↓ ↑↓ ↑↓ ↑↓
 3d10 ↑
3d10 ↑
4s1
б) электронная формула катиона Cu2+:
 |






 Cu2+ )))) ↑↓ ↑↓ ↑↓ ↑↓ ↑ 4p0
Cu2+ )))) ↑↓ ↑↓ ↑↓ ↑↓ ↑ 4p0






 2 8 17 0 3d9
2 8 17 0 3d9
4so :NH3 :NH3 : NH3: NH3
CuSO4 + 4: NH3 -à [Cu(NH3)] SO4
[Cu(NH3)] SO4 à [Cu(NH3)4 ]2+ + SO42-
|
|
|


ионная связь
ков. связь
по донорно- акцепторному механизму.
Упражнение для самостоятельного решения:
Изобразите строение комплексного иона [Fe(CN)6]3- по алгоритму:
а) напишите электронную формулу атома железа;
б) напишите электронную формулу иона железа Fe3+, убрав электроны с 4s подуровня и 1 электрон с 3d- подуровня;
в) перепишите электронную формулу иона еще раз, переведя электроны 3d- подуровня в возбужденное состояние путем их спаривания в ячейках этого подурвня
г) подсчитайте число всех свободных ячеек на 3d, 4s, 4p - подуровнях
д) расположите под ними цианид-анионы CN- и проведите стрелки от ионов к пустым ячейкам.
II.5. Определение заряда комплексообразователя и комплексного иона:
1.Заряд комплексного иона равен заряду внешней сферы с обратным знаком; он также равен сумме заряда комплексообразователя и всех лигандов.
+2 -1 х
K2[HgI4] +2+ (- 1) ·4 =х х = -2
2. Заряд комплексообразователя равен алгебраической сумме зарядов лигандов и внешней сферы (с обратным знаком).
х 0 -1
[Ag(NH3)2] Cl х +0·2 +(–1)·2 = 0; х=2-1= +1
х 0 2-
[Cu(NH3)4] SO4 х+ 4· 0 -2 = 0 х = +2
3.Чем больше заряд центрального атома и меньше заряд лиганда, тем больше координационное число.
II.6. Номенклатура.
Существует несколько способов названий комплексных соединений. Выберем более простой с использованием валентности (или степени окисления) центрального атома
II.6.1. Название комплексных соединений катионного типа:
Комплексные соединения относятся к катионному типу, если заряд комплексного иона положительный.
При названии комплексных соединений:
1) сначала называется координационное число с помощью греческих приставок (гекса, пента, три);
2) затем, заряженные лиганды с добавлением окончания «о»;
3) затем, нейтральные лиганды (без окончания «о»);
4) комплексообразователь на русском языке в родительном падеже, указывается его валентность или степень окисления и после этого называется анион. Аммиак – лиганд называется «аммин» без «о», вода –«аква»
|
|
|
Примеры:
[Cu(NH3)4] SO4 тетрааммин меди (II) сульфат;
[Ag(NH3)2] Cl диаммин серебра (I) хлорид;
[CoI6] Cl3 – гексаиодокобальта (Ш) хлорид;
[Al(C2O4)(H2O)5] Cl – оксалатопентаакваалюминия(Ш) хлорид
(окалат - двухзарядный анион щавелевой кислоты);
[Fe(H2O)6]Cl3 –гексаакважелеза(Ш) хлорид.
II.6.2. Номенклатура комплексных соединений анионного типа.
Называется катион, координационное число, лиганды и, затем, комплексообразователь - центральный атом. Комплексообразователь называется на латинском языке в именительном падеже с окончанием «ат».
Примеры:
K3[FeF6] – калия гексафтороферрат(Ш);
Na3[Co(NO2)6] – натрия гексанитрокобальтат (III);
NH4 [Hg(CO)2 (SCN)2] –аммония дитиоцианодикарбонил меркуриат (I)
Нейтральный комплекс: [Fe(CO)5] – пентакарбонил железо.
ПРИМЕРЫ И ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
Пример 1. Классифицировать, полностью охарактеризовать и дать названия следующим комплексным соединениям: а) K 3 [ Ag (SO 3 S)2] –; б) [ Co (NH 3)4 Cl 2 ] Cl; в) [ W (CO)6].
Решение и ответ:
а)
1) K3[Ag(SO3S)2] - 3 иона К+ - внешняя сфера, ее общий заряд +3, [Ag(SO3S)2]3- - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3-)
2) Комплексное соединение анионного типа, так как заряд внутренней сферы - отрицательный;
3) Центральный атом - комплексообразователь - ион серебра Ag+
4) Лиганды - два двухзарядных остатка тиосерной кислоты H2S2O3, относится к ацидокомплексам
5) Координационное число комплексообразователя в данном случае как исключение равно 4 (у двух остатков кислоты 4 валентных σ - связи без 4-х катионов водорода);
6) Заряд комплексообразователя равен +1:
+1 х -2 0
K3[Ag(SO3S)2]: +1 · 3 + Х + (-2) · 2 = 0 à X= +1
23
7) Название: – калия дитиосульфатоаргентат (I).
б)
1) [Co(NH3)4Cl2]Cl - 1 ион - Сl- - внешняя сфера, ее общий заряд -1, - [Co(NH3)4Cl2] - внутренняя сфера, ее общий заряд равен заряду внешней сферы, взятому с противоположным знаком - (3+)
2) Комплексное соединение катионного типа, так как заряд внутренней сферы - положительный.
3) Центральный атом - комплексообразователь - ион кобальта Со, вычисляем его заряд:
х 0 -1 1+
[Co(NH3)4Cl2]: Х + 0 · 4 + (-1) · 2 = +1 à Х = 0 +2 +1 = +3
4) Комплексное соединение смешанного типа, так как в его составе разные лиганды; ацидокомплекс (Cl-- остаток хлороводородной кислоты) и амминкамплекс - аммиакатный (NH3 - аммиак-нейтральное соединение)
5) Координационное число комплексообразователя равно 6;
|
|
|
6) Название – дихлоротетраамминкобальта(III) хлорид.
в)
1) [W(CO)6] - внешней сферы нет
2) Комплексное соединение нейтрального типа, так как заряд внутренней сферы = 0.
3) Центральный атом - комплексообразователь - атом вольфрама,
его заряд =0
4) Карбонилкомплекс, так как лигандом является нейтральная частица - карбонил - СО;
5) Координационное число комплексообразователя равно 6;
6) Название: – гексакарбонилвольфрам
Задание 1. Охарактеризуйте комплексные соединения:
а) Li 3 Cr (OH)6]
б) [ Zn (H 2 O)3 F] I 2
в) [ Pt Cl 2 (NH 3)2] и дайте им названия.
Задание 2. Назовите комплексные соединения: [ Co (NH 3)4(NO 2)2] NO 3,
K 3 [ Al (C 2 O 4)3 ], Na 3 [ Co (NO 2)6], H [ AuCl 4 ], Fe3[ Cr (CN)6]2
|
|
|


