 |
Краткие теоретические сведения
|
|
|
|
ИЗУЧЕНИЕ КВАНТОВЫХ ЧИСЕЛ
Цель работы: пользуясь спектром испускания ртути, определить квантовые числа, соответствующие уровням энергии атомов ртути.
Оборудование: монохроматор УМ-2, ртутная и неоновая лампы.
Краткие теоретические сведения
Каждое состояние электрона в атоме характеризуется четырьмя квантовыми числами: n, l, m, mS ].
Число n – главное квантовое число. Оно определяет энергию взаимодействия электрона с ядром. Число n принимает значения 1, 2, 3,.... Орбитальное квантовое число l определяет энергию взаимодействия данного электрона с другими электронами. Число l принимает значения: 0, 1, 2,... n – 1. Магнитное квантовое число m определяет энергию взаимодействия электрона с внешними электрическими или магнитными полями. В данной работе это квантовое число изучаться не будет. Наконец, четвертое квантовое число ms называется спиновым. Оно принимает только два значения: + ½ и – ½. Введение спинового квантового числа связано с тем, что электрон в атоме, вращается не только вокруг ядра, но и вокруг собственной оси (подобно маленькому волчку). Оба эти движения можно рассматривать, как своеобразные круговые «токи», которые между собой должны взаимодействовать с помощью магнитных сил. Энергию этого взаимодействия и определяет спиновое квантовое число.
Согласно принципу Паули, для двух электронов, находящихся на одном энергетическом уровне с одними и теми же квантовыми числами n, l, m, спиновые квантовые числа отличаются только знаками:
mS 1 = +½ и mS 2 = – ½.
Если атом на последнем энергетическом уровне с номером n содержит несколько электронов, то квантовые числа l и mS отдельных электронов, складываясь, дают орбитальное квантовое число атома l АТ и спиновое квантовое число атома mS АТ соответственно (квантовые числа внутренних электронов можно не учитывать). Кроме того, квантовые числа l АТ и mS АТ, складываясь по определённому правилу, образуют квантовое число атома j.
|
|
|
Рассмотрим, какими квантовыми числами характеризуются электроны в атоме ртути. На последнем энергетическом уровне здесь содержатся два электрона. При возбуждении атома один из электронов переходит на более высокий свободный уровень. При возвращении электрона в исходное состояние атом испускает квант света с определенной частотой и длиной волны. Таких переходов может быть множество.
Таблица 1
| Тип уровней | Синглет | Триплет | ||||||||||||
| Спиновые квантовые числа электронов | mS 1 = 1/2 mS 2 = – 1/2 | mS 1 = 1/2 mS 2 = 1/2 | ||||||||||||
| Квантовое число mS АТ | 0 | 1 | ||||||||||||
| Квантовое число lS АТ | 0 | 1 | 2 | 3 | 0 | 1 | 2 | 3 | ||||||
| Максимальное количество значений числа j | 1 | 1 | 1 | 1 | 3 | 3 | 3 | 3 | ||||||
| Квантовое число j | 0 | 1 | 2 | 3 | 1 | 2 | 1 | 0 | 3 | 2 | 1 | 4 | 3 | 2 |
| Символ атомного состояния | 1 S 0 | 1 P 1 | 1 D 2 | 1F3 | 3S1 | 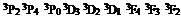
| ||||||||

Рис. 1
Они и порождают спектр испускания, который с помощью монохроматора можно наблюдать как совокупность цветных линий на сплошном черном фоне.
В возбужденном атоме ртути у электронов спиновые числа могут быть как одинаковыми так и разными по знаку. Здесь нет ограничений по принципу Паули, так как электроны находятся на разных уровнях. Это означает, что результирующее спиновое число атома mS АТ может принять два разных значения: либо mS АТ = ½ – ½ = 0, либо mS АТ = ½ + ½ = 1. Уровни энергии, для которых mS АТ = 0, называются синглетными (одиночными), а уровни, для которых mS АТ = 1, называются триплетными (тройными). Названия объясняются тем, сколько разных значений квантового числа j соответствует данному уровню. А именно, число j принимает целые значения в интервале:
|
|
|
| l АТ – mS АТ | ≤ j ≤ l АТ + mS АТ.
Следовательно, если mS АТ = 0, то каждой паре значений l АТ и mS АТ соответствует только одно значение числа j, совпадающее с l АТ. Если же mS АТ = 1, то для каждой пары значений l АТ и mS АТ возможны три разных значения числа
j: j = l АТ – 1; j = l АТ + 0; j = l АТ +1. Каждому значению числа j соответствует определенная энергия атома. Таким образом, триплетный уровень – это набор трех близких по значению разных уровней энергии.
Введено специальное обозначение уровней энергии, учитывающее значения всех квантовых чисел данного уровня. Сначала цифрой записывается значение главного квантового числа n. Затем латинскими буквами S, P, D, F,... обозначают орбитальное квантовое число l АТ, его значения цифрами 0, 1,2, 3,... соответственно. Значение числа j обозначается нижним индексом, а количество разных значений числа j – верхним индексом, Например, символ 63 Р 2 означает, что n = 6, l АТ = 1, j = 2, число разных значений j равно 3, а
mS АТ = 1. В табл. 1 указано, как расшифровать все символические обозначения уровней энергии. На рис. 1 изображены уровни энергии атома ртути. Стрелки показывают различные переходы, каждый из которых соответствует какой-нибудь линии в спектре испускания ртути. Уровни с одинаковыми квантовыми числами l АТ, mS АТ, j и разными квантовыми числами n изображены столбцами друг над другом. Слева от уровня приводится значение главного квантового числа, символ общих квантовых чисел для всех уровней данного столбца пишется вверху над столбцами. Над стрелкой, означающей переход, указана длина волны излучения в нанометрах (нм) 1 нм = 10-9 м.
Таким образом, если экспериментально измерить длину волны каждой наблюдаемой линии спектра ртути, то с помощью табл. 1 и рис. 1 можно определить, между какими уровнями произошел переход и какими квантовыми числами эти уровни характеризуются.
Описание установки
Длины волн спектра ртути измеряются с помощью монохроматора УМ-2, оптическая схема которого представлена на рис. 2. Свет от лампы
с парами ртути 1 фокусируется линзой 2 на входную щель 3 монохроматора УМ-2. Щель 3 находится в фокусе линзы 4 и входит в подвижную часть прибора, в так называемый коллиматор.
|
|
|
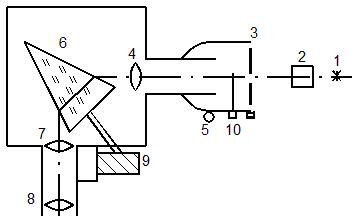
Рис. 2
Таблица 2
Длины волн спектра испускания неона
| Номер линии | Цвет и положение спектральных линий | Длина волны, x10-9 м | Интенсивность, онт. ед. |
| 1 | Красная, наиболее яркая среди красных | 640 | 20 |
| 2 | Красно-оранжевая, левая из двух близких линий | 614 | 10 |
| 3 | Желтая, самая яркая линия | 585 | 20 |
| 4 | Зеленая, левая из двух ярких линий | 540 | 20 |
| 5 | Зеленая, правая из двух ярких линий (дублетная) | 533 | 10 |
| 6 | Зеленая, правая из пяти равноудаленных линий | 503 | 5 |
| 7 | Сине-зеленая | 483 | 10 |
| 8 | Синяя | 465 | 3 |
| 9 | Сине-фиолетовая | 438 | 1,5 |
| 10 | Сине-фиолетовая | 428 | 1 |
| 11 | Сине-фиолетовая | 422 | 1 |
Примечание. Для облегчения наблюдения красной линии № 1, красно-оранжевой линии № 2 и желтой линии № 3 вся красно-желтая часть спектра неона представлена на отдельном рис. 3, приведенном на лабораторном стенде.
Вращая маховик 5, можно перемещать коллиматор вдоль оптической оси. Пройдя линзу 4, свет падает на призму 6 и разлагается в спектр. Линза 7 фокусирует спектр в области наблюдения. Наблюдают спектр через окуляр 8, имеющий накатное кольцо, вращением которого можно добиваться наиболее резкой картины наблюдения спектра. В нижней части щели 3 находится микрометрический винт, позволяющий изменять ширину щели.
Спектр исследуют, вводя постепенно на середину поля зрения нужную область. Для этого вращают барабан 9, расположенный справа от зрительной трубы монохроматора. Барабан снабжен шкалой, позволяющей определить повороты в градусах. Цена деления шкалы составляет 2О. Отсчет положения спектральной линии производится в момент совмещения спектральной линии со стрелкой-указателем в центре поля зрения. Стрелка-указатель и картина должны наблюдаться одинаково четко. Для этого устанавливают окуляр на резкое наблюдение стрелки указателя, а затем, вращая маховичок 5, добиваются резкого изображения спектра. Входная щель имеет заслонку 10, прерывающую световой поток. В рабочем положении заслонка всегда открыта. Шкала барабана градуируется в длинах волн. Для этого используется хорошо изученный спектр излучения неона (рис. 3 и табл. 2). Для градуирования необходимо определить, каким значениям длин волн линий спектра неона соответствуют показания шкалы поворота барабана.
|
|
|
Порядок выполнения работы
1. Установить на оптическом рельсе неоновую лампу и направить ее излучение на входную щель монохроматора. Добиться минимальной ширины щели. Наблюдая через окуляр спектр неона, совместить со стрелкой-указателем каждую из линий, описанных в табл. 2. Значения угла поворота по шкале барабана и длины волны из табл. 2 занести в табл. 3. Переходя от ярких красных, оранжевых и желтых линий к слабым линиям в зеленой и синей областях спектра, следует постепенно увеличивать ширину щели.
Таблица 3
| Номер линии спектра неона, цвет линии | Длина волны λ (x10-9 м) | Угол поворота φ барабана (град) |
2. Используя данные табл. 3, на миллиметровой бумаге построить график зависимости делений шкалы φ от длины волны λ. При построении графика придерживаться следующих масштабов. На оси «длина волны» 1 см должен соответствовать 10∙10-9 м, на оси «деления шкалы» 1 см должен соответствовать 1000.
3. Установить на оптическом рельсе ртутную лампу и направить ее излучение на щель. Добиться минимальной ширины щели. Вращая барабан, просмотреть всю видимую часть спектра. Занести в табл. 4 показания шкалы барабана, соответствующие каждой указанной в таблице линии спектра ртути.
4. Пользуясь градуировочным графиком, определить длины волн спектральных линий ртути.
5. С помощью рис. 1 установить, между какими уровнями происходили переходы, вызвавшие излучение атомов ртути с полученными длинами волн. С помощью табл. 1 найти значения квантовых чисел n, l АТ, mS АТ, j, соответствующих этим уровням. Результаты занести в табл. 4.
6. Начертить схему и оценить энергию возбуждения найденных уровней. Цветными линиями обозначить переходы, соответствующие наблюдаемым линиям спектра ртути.
Таблица 4
| Спектральная линия ртути (цвет) | Показания шкалы барабана, град | Длина волны, 10-9 м | Символ верхнего уровня перехода | Символ нижнего уровня перехода | Квантовые числа верхнего уровня | Квантовые числа нижнего уровня | Энергия возбуждения, эВ | ||||||
| n | l | mS | j | n | l | mS | j | ||||||
| Желтая | |||||||||||||
| Желтая | |||||||||||||
| Зеленая | |||||||||||||
| Сине-зеленая | |||||||||||||
| Синяя | |||||||||||||
| Синяя | |||||||||||||
| Синяя | |||||||||||||
| Фиолетовая | |||||||||||||
| Фиолетовая | |||||||||||||
Контрольные вопросы
|
|
|
1. Какой физический смысл имеют квантовые числа n, l, mS, j?
2. Объяснить, почему для заполненных электронных оболочек в атоме l АТ = 0 и mS АТ = 0.
3. В чем различие синглетных и триплетных уровней?
Библиографический список
|
|
|


