 |
Краткие теоретические сведения
|
|
|
|
ИЗУЧЕНИЕ СПЕКТРА ПОГЛОЩЕНИЯ ПАРОВ ЙОДА
Цель работы: с помощью спектра поглощения паров йода определить частоту колебаний, силовую постоянную и энергию диссоциации молекулы йода.
Оборудование: кювета с порошком йода, лампа накаливания, неоновая лампа, монохроматор УМ-2, оптический рельс.
Краткие теоретические сведения
Наблюдая спектр поглощения света, можно получить подробную информацию о строении молекул. Как известно, поглощение света возникает при переходе электронов с одной орбиты на другую, более удаленную от ядра. Графически это изображается, как переход электрона с основного уровня энергии 1 на энергетически более высокий уровень 2 (рис. 1). Поглощая свет, электрон, а вместе с ним и атом, приобретает энергию D Е = Е 2 – Е 1, где Е 1, Е 2 – энергии электронных уровней 1 и 2 соответственно.
Когда атомы объединяются в молекулы, каждый из электронных уровней 1, 2,…..расщепляется на множество подуровней 1`, 1``, 1```..., 2`, 2``, 2```….соответственно. Это связанно с тем, что в молекулах движутся не только электроны, но и атомы, которые колеблются относительно друг друга. Так, в двухатомной молекуле йода J 2 атомы колеблются относительно центра молекулы с частотой nкол (рис. 2). Энергия этого движения, как и электронного, принимает дискретные значения, т. е. образует уровни. При одной и той же электронной энергии молекула может обладать разной колебательной энергией, т. е. находиться на разных колебательных подуровнях в пределах одного и того же электронного уровня.
Расположение подуровней определяется зависимостью колебательной энергии Е кол от межатомного расстояния r (рис. 3). В своей нижней части кривая этой зависимости Е кол (r) имеет вид потенциальной ямы с параболическими стенками. Энергии колебательных подуровней, подчинены правилам квантования
|
|
|
Е кол= h nкол(n кол+1/2), (1)
где Е кол – энергия колебательного подуровня с квантовым числом nкол, nкол принимает значения 0, 1, 2,…; nкол – частота колебаний атомов йода:
h – постоянная Планка.
Значение нулевой энергии  соответствует половине колебательного кванта
соответствует половине колебательного кванта  .
.
Амплитуды колебаний атомов x сравнимы с равновесным расстоянием r0 между атомами в молекуле (точки r 0+ xi на рис.3).
|
|
|
|
|
|
|

Рис. 1
|
|
|
|
|
|
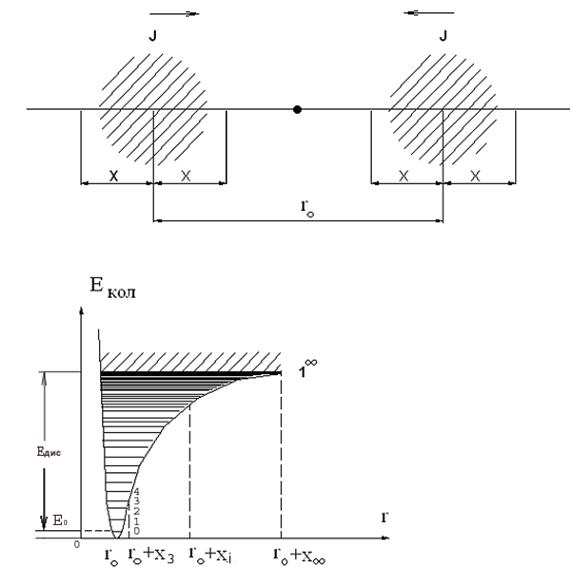
Рис. 3
Из формулы (1) следует, что квант колебательной энергии соответствует разности энергий двух соседних подуровней, для которых число n кол отличается на 1:
DЕкол=hnкол . (2)
Это означает, что подуровни гармонических колебаний располагаются через одинаковые промежутки D Е кол (эквидистантно).
При энергиях, соответствующих верхней асимметричной части потенциальной кривой (рис. 3), колебания молекул имеют достаточно большие амплитуды по сравнению с r 0. Эти колебания являются ангармоническими и характеризуются множеством различных частот. Соответствующие этим колебаниям подуровни постоянно сближаются. При  , кривая Е (r) становится горизонтальной, соответствующие этому участку подуровни сливаются в непрерывную полосу (континуум). На рис. 1 и 3 континуум изображен наклонной штриховкой. Граничный подуровень, отделяющий дискретные подуровни от континуума, обозначен индексом ¥. Переход молекулы на подуровень 1¥ означает неограниченно большое возрастание амплитуды (точка r 0+ x ¥). Обладая такой колебательной энергией, атомы могут преодолеть взаимное притяжение и разойтись, не возвращаясь к равновесному расстоянию r 0. Это означает, что молекула диссоциирует (распадается).
, кривая Е (r) становится горизонтальной, соответствующие этому участку подуровни сливаются в непрерывную полосу (континуум). На рис. 1 и 3 континуум изображен наклонной штриховкой. Граничный подуровень, отделяющий дискретные подуровни от континуума, обозначен индексом ¥. Переход молекулы на подуровень 1¥ означает неограниченно большое возрастание амплитуды (точка r 0+ x ¥). Обладая такой колебательной энергией, атомы могут преодолеть взаимное притяжение и разойтись, не возвращаясь к равновесному расстоянию r 0. Это означает, что молекула диссоциирует (распадается).
|
|
|
Переходы молекулы с колебательных подуровней 1`, 1``,…. электронного уровня 1 основного состояния молекулы на колебательные подуровни 2`, 2``,…более высокого электронного уровня 2 возбужденного состояния молекулы порождают спектр поглощения вещества. При визуальном наблюдении с помощью монохроматора спектр представляет собой совокупность темных полос на светлом фоне. В красной, жёлтой, зелёной областях спектра полосы расположены примерно на одинаковом расстоянии друг от друга – эквидистантно. В синей области они начинают заметно сближаться и наконец сливаются в континуум. Эквидистантные дискретные полосы соответствуют переходам между подуровнями для гармонических колебаний молекулы (переходы а и b на рис. 1). Сблизившиеся полосы в коротковолновой области спектра – ангармоническим колебаниям. Сплошной спектр поглощения – переходам с подуровней 1`,1``,…уровня 1 в область континуума колебательной энергии уровня 2. Такие переходы сопровождаются диссоциацией молекулы (переходы с и d на рис. 1). Излучение с частотами, соответствующими темным полосам, поглощается молекулой и превращается в тепло.
Характерно, что в отличие от атомов, имеющих узкие линии поглощения, молекулы в своих спектрах имеют широкие полосы. Это связано с тем, что молекула в отличие от атома может вращаться как целое около центра инерции, т. е. наряду с электронной и колебательной может обладать еще и вращательной энергией.
Вращательная энергия тоже квантуется (образует подуровни). Промежутки между вращательными подуровнями настолько малы по сравнению с квантами колебательной энергии D Е кол, что становятся неразличимыми. Вращательные подуровни, относящиеся к одному и тому же колебательному подуровню, практически сливаются в непрерывную полосу (рис. 1). Переходы молекулы с равных вращательных подуровней основного электронно-колебательного состояния 1` на вращательные подуровни какого-либо возбужденного состояния (например, 2`) порождают множество линий с чрезвычайно близкими частотами. Эти линии, сливаясь в континуум, образуют определенную молекулярную полосу поглощения. Аналогично возникают и другие полосы.
|
|
|
Зная величину колебательного кванта  и используя закон сохранения энергии, можно, согласно (2), определить частоту гармонических колебаний молекулы. Действительно, для пары переходов а и b с низшего подуровня 1` на эквидистантные соседние подуровни электронного уровня 2` (рис. 1) можно записать:
и используя закон сохранения энергии, можно, согласно (2), определить частоту гармонических колебаний молекулы. Действительно, для пары переходов а и b с низшего подуровня 1` на эквидистантные соседние подуровни электронного уровня 2` (рис. 1) можно записать:
DЕкол=D Еа – D Е b, (3)
где D Еа, D Е b –энергии поглощенные молекулой при переходах а и b соответственно.
Из теории Бора известно, что
D Еа = h n a, D Eb = h n b, (4)
где n а , n b – частоты переходов a и b соответственно.
Подставляя равенства (2) и (4) в (3), получаем:
nкол=na – nb. (5)
Чтобы определить частоту колебаний nкол, необходимо измерить частоты n a , n b пары переходов a и b, т. е. частоты любой пары соседних эквидистантных полос поглощения.
Зная частоту nкол, можно приближенно определить коэффициент жесткости К молекулы, называемый силовой постоянной, по формуле для частоты гармонических колебаний:
 , (6)
, (6)
где М – приведенная масса молекулы йода,  , m 1, m 2 – массы атомов,
, m 1, m 2 – массы атомов,  входящих в молекулу. Для йода m 1= m 2=127 а.е.м. (1 а.е.м. = 1,7∙10-27кг).
входящих в молекулу. Для йода m 1= m 2=127 а.е.м. (1 а.е.м. = 1,7∙10-27кг).
Из формулы (6) получим:
К =(2pnкол)2 М. (7)
|
|
|
Спектры поглощения позволяют приближенно оценить энергию диссоциации Е дис молекулы, т. е. энергию, необходимую для ее разрыва на отдельные атомы. Поглощение молекулой такой энергии порождает переход с низшего колебательного подуровня в область континуума колебательной энергии в пределах одного и того же электронного уровня (преходы f и g на рис. 1.) Для симметричных молекул (в частности для молекулы йода) такие переходы запрещены.
Поэтому в данной работе Е дис определяется по разности энергий, поглощенных молекулой, при переходах j и l из основного (рис. 1) в первое возбужденное электронное состояние (1–2):
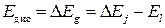 . (8)
. (8)
Учитывая:
D Е j = h n j, D El = h n l, (9)
получим:
E дис = h (n j – n l), (10)
где n j, n l – частоты электронно-колебательных переходов j и l соответственно.
Переход l порождает в спектре поглощения темную полосу минимальной частоты, ближайшую к инфракрасной области. Переход j -полосу поглощения максимальной частоты, за которой следует континуум спектра поглощения, т. е. ближайшую к ультрафиолетовой области спектра. Таким образом, для определения энергии диссоциации необходимо измерить частоты
vl, vj указанных полос поглощения. При этом предполагается, что в исходном состоянии молекула находится на низшем уровне  основного электронного состояния I. Основанием для такого предположения является распределение Больцмана, согласно которому при комнатной температуре подавляющее большинство молекул находится на этом подуровне
основного электронного состояния I. Основанием для такого предположения является распределение Больцмана, согласно которому при комнатной температуре подавляющее большинство молекул находится на этом подуровне  .
.
Описание установки
Частоты измеряются с помощью установки, оптическая схема которой представлена на рис.4. Свет от лампы накаливания 1 проходит через кювету с йодом 2 и направляется на входную щель 3 монохроматора УМ-2. Входная щель 3 находится в фокусе линзы 4 и вместе с тубусом образует подвижную часть прибора, так называемый коллиматор. Вращая маховичок 5, можно перемещать коллиматор вдоль оптической оси. Пройдя линзу 4, свет параллельным пучком падает на призму 6 и разлагается в спектр, который фокусируется линзой 7 в области наблюдения. Спектр рассматривают через окуляр 8, имеющий накатное кольцо, вращая которое можно добиться наиболее резкой картины изменения спектра. В нижней части щели 3 расположен микрометрический винт, позволяющий изменять ширину щели.
Спектр исследуют, вводя на середину поля зрения его нужную часть. Для этого вращают барабан 9, расположенный справа от зрительной трубы монохроматора. Барабан снабжен шкалой, определяющей повороты в градусах. Цена деления шкалы составляет 2°. Отсчет положения спектральных линий производится в момент совмещения линии со стрелкой-указателем в центре поля зрения. Стрелка указатель и картина спектра должны наблюдаться одинаково резко. Для этого следует установить окуляр на резкое наблюдение стрелки-указателя, а затем, вращая маховичок 5, добиться резкой картины изображения спектра. Входная щель имеет заслонку 10, прерывающую световой поток. В рабочем положении заслонка должна быть открыта. Шкала барабана градуируется в частотах. Для этого используется хорошо изученный спектр излучения неона (табл. 1, рис. 5). Для градуирования необходимо определить, каким значением угла поворота барабана соответствуют значения частот наблюдаемых линий спектра неона.
|
|
|
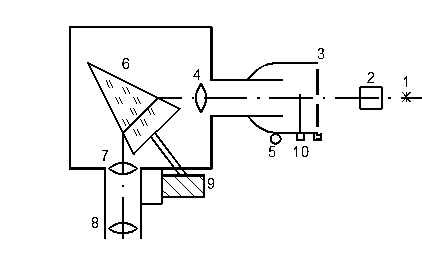
Рис. 4
Порядок выполнения работы
1. Установить на оптическом рельсе неоновую лампу и направить ее излучение на входную щель монохроматора так, чтобы ширина щели была минимальной. Наблюдая через окуляр спектр неона, совместить со стрелкой-указателем каждую из линий, описанных в табл. 1. Значение угла поворота по шкале барабана и частоту из табл. 1 занести в табл. 2. Переходя от ярких красных, оранжевых и желтых линий к слабым линиям в зеленой, синей частях спектра, следует постепенно увеличивать ширину щели.
Таблица 1
Частоты спектра испускания неона
| Номер п/п | Цвет и положение спектральной линии | Частота (1012 Гц) | Интенсивность (отн. ед.) |
| 1 2 3 4 5 6 7 8 9 10 11 | Красная, наиболее яркая среди красных линий Красно-оранжевая, левая из двух близких линий Желтая, самая яркая линия Зеленая, левая из двух ярких линий Зеленая, правая из двух ярких линий (дублетная) Зеленая, правая из пяти равноудаленных линий Сине-зеленая Синяя Сине-фиолетовая Сине-фиолетовая Сине-фиолетовая | 469 490 515 556 563 596 621 645 685 701 711 | 20 10 20 20 10 5 10 3 1,5 1 1 |
Примечание. Для облегчения наблюдения красной линии №1, красно-оранжевой №2 и желтой линии №3 вся красно-желтая часть спектра неона представлена на отдельном рис.5, приведенном на лабораторном стенде.
Таблица 2
| Номер линии спектра неона, ее цвет | Частота n, 1012Гц | Угол поворота барабана j, град |
2. Пользуясь данными табл. 2 на миллиметровой бумаге построить график зависимости делений шкалы j от частоты n. При построении графика придерживаться следующих масштабов. На оси "частота" 1 см должен соответствовать 10×1012 Гц, на оси "деления шкалы" 1 см должен соответствовать 100°.
3. Установить на оптическом рельсе лампу накаливания 1 и кювету с йодом 2 согласно рис. 4. Свет от лампы 1, прошедший через кювету 2, направить на щель монохроматора так, чтобы ширина щели была минимальной. Наблюдая через окуляр спектр поглощения, совместить с указателем 5–6 темных эквидистантных полос подряд в желто-зеленой, наиболее четкой области спектра. Определить значение шкалы барабана, соответствующее каждой полосе. Используя построенный градуировочный график, найти частоты этих полос. По формуле (5) вычислить частоту nкол гармонических колебаний молекулы йода. Полученные данные занести в табл. 3.
4. Совместить с указателем полосу поглощения минимальной частоты n l , ближайшую к инфракрасной области (крайнюю слева), и определить ее положение по шкале барабана. Аналогично установить положение полосы максимальной частоты n j, ближайшей к ультрафиолетовой части спектра (крайней дискретной полосы справа). Пользуясь построенным градуировочным графиком, найти частоты этих полос n l, n j. По формуле (10) вычислить энергию диссоциации Е дис. Полученные результаты занести в табл. 3.
5. По формуле (7) вычислить силовую постоянную (коэффициент жесткости) молекулы йода.
6. Вычислить энергию D Е l перехода 1–2 по формуле D Е l = h n l и энергию колебательного кванта по формуле (3). Пользуясь полученными результатами, начертить в масштабе относительное расположение электронных уровней 1 и 2 и колебательных подуровней 1`,1``,1```,…,2`,2``,2```[*].
Таблица 3
| Номер полосы поглощения | Показания шкалы j, град | Частота полосы 1012 Гц | Частота молекулы 1012 Гц | Энергия диссоциации (Дж) |
Контрольные вопросы
1. Чем отличаются уровни энергии молекул от уровней энергии изолированных атомов?
2. Почему колебательные подуровни и, соответственно, полосы поглощения располагаются не на одинаковом расстоянии, как этого требует формула (1), а постепенно сближаются?
3. Какой физический смысл имеет коэффициент жесткости К молекулы?
4. Почему с увеличением частоты полосы поглощения становятся все более светлыми?
5. Какому физическому состоянию соответствует область непрерывных значений энергии?
[*] Савельев, И. В. Курс общей физики / И. В. Савельев. – М.: Наука, 1977. – Т. 1. – § 50; 1978. – Т. 2. – §145; 1979. – Т. 3 – §15, 39, 30.
|
|
|


