 |
В ней плоскости азотистых оснований не перпендикулярны оси спирали, а наклонены на 200 к перпендикуляру.
|
|
|
|
Все синтезируемые полипептиды прокариот на N-конце несут формилметионин.
В 20% случаев он отщепляется, а в 80% отщепляется только формильная группа и на N конце остается метионин.
Ингибиторы транскрипции прокариот.
Существует множество ингибиторов транскрипции. Они действуют по разным механизмам и на разных стадиях. Большинство из них - антибиотики.
Рифампицин - ингибитор инициации.
Связывается с центром инициации holo -РНК-полимеразы E. сoli.
Стрептолидигин - ингибитор элонгации.
Связывается с центром элонгации core -РНК-полимеразы E. сoli.
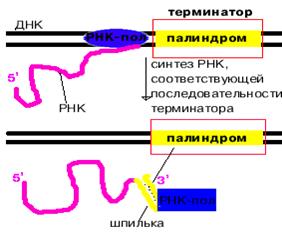
При P - независимой терминации в терминаторе присутствует палиндром. В синтезируемой РНК формируется шпилька. Шпилька меняет конформацию РНК-полимеразы и фермент теряет сродство к ДНК.
При P - независимой терминации в терминаторе присутствует палиндром. В синтезируемой РНК формируется шпилька. Шпилька меняет конформацию РНК-полимеразы и фермент теряет сродство к ДНК.

Схема негативной индукции Жакоба и Моно
Lac -оперон E. coli содержит 3 гена, отвечающие за образование белков, участвующих в переносе в клетку дисахарида лактозы и в ее расщеплении.
В отсутствие в клетке лактозы lac - оперон выключен.
Активный белок - репрессор, кодируемый в моноцистронном опероне (LacI), не имеющем оператора, связан с оператором lac -оперона. Поскольку оператор перекрывается с промотором, даже посадка РНК-полимеразы на промотор невозможна.
Как только некоторое количество лактозы попадает в клетку, две молекулы субстрата (лактозы) взаимодействуют с белком - репрессором, изменяют его конформацию - и он теряет сродство к оператору.
Тут же начинается транскрипция lac -оперона и трансляция образующейся mРНК; три синтезируемых белка участвуют в утилизации лактозы.
|
|
|

Когда вся лактоза переработана, очередная порция репрессора, свободного от лактозы, выключает lac -оперон.
Существует и позитивная регуляция работы lac -оперона E. coli.
Схема позитивной индукции
Аra -оперон E. сoli.

В нем 3 цистрона, которые кодируют ферменты, расщепляющие сахар арабинозу. В норме оперон закрыт. Белок - репрессор связан с оператором.
Когда в клетку попадает арабиноза, она взаимодействует с белком - репрессором. Белок - репрессор меняет конформацию и превращается из репрессора в активатор, взаимодействующий с промотором и облегчающий посадку РНК-полимеразы на промотор.
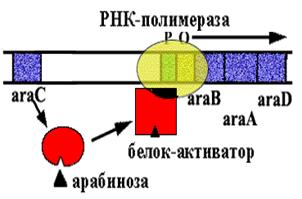
Эта схема регуляции называется позитивной индукцией, поскольку контролирующий элемент - белок - активатор "включает" работу оперона.
Схема позитивной репрессии
Оперон синтеза рибофлавина у Вacilus subtilis.
Эта схема регуляции называется позитивной индукцией, поскольку контролирующий элемент - белок - активатор "включает" работу оперона.
Схема позитивной репрессии
Оперон синтеза рибофлавина у Вacilus subtilis.

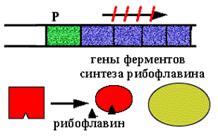
N+1-ая молекула (лишняя) взаимодействует с активатором и он теряет способность активировать посадку РНК-полимеразы на промотор.
N+1-ая молекула (лишняя) взаимодействует с активатором и он теряет способность активировать посадку РНК-полимеразы на промотор.
Схема негaативной репрессии
Оперон синтеза триптофана у E. сoli.

В опероне имеется 5 цистронов, которые кодируют ферменты последовательной цепи реакций синтеза триптофана. В норме оперон включен. Белок - репрессор неактивен (в форме апо-репрессора), он не способен садиться на оператор.
Клетке нужно N молекул триптофана. N+1-ая молекула взаимодействует с апо-репрессором. Он меняет конформацию, садится на оператор и синтез РНК прекращается.
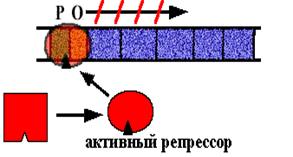
Схема регуляции - негативная репрессия, потому что белок репрессор "выключает" оперон.
|
|
|
Позитивный контроль работы lac -оперона
Lac -оперон, подчиняющийся схеме негативной индукции, имеет и позитивный контроль.

цАМФ образуется из АТФ ферментом аденилатциклазой. Фосфодиэстераза превращает цАМФ в АМФ.
Глюкоза активирует второй и инактивирует первый фермент. Чем больше в клетке глюкозы, тем меньше цАМФ.

Если нет глюкозы, то цАМФ соединяется с белком катаболической репрессии (САР) и образуется комплекс САР·цАМФ, активирующий посадку РНК-полимеразы на промотор. В присутствии лактозы lac -оперон включается и работает.
Если же в клетке есть еще и глюкоза (более экономичный источнок энергии), то нет цАМФ - и активатор не образуется, lac -оперон работает "вяло", без дополнительной индукции
Синтез белка в клетке состоит из двух этапов: рекогниции и собственно синтеза полипептида на рибосоме. Ключевым субстратом рекогниции является транспортная РНК.
Структура транспортной РНК
Транспортные РНК (tРНК) - короткие молекулы (70-90 нукл.), имеющие и вторичную, и третичную структуру.
 Вторичная структура - "клеверный лист". Последовательность CCA на 3'-конце одинакова для всех tРНК. К концевому аденозину (А) присоединяется аминокислота.
Вторичная структура - "клеверный лист". Последовательность CCA на 3'-конце одинакова для всех tРНК. К концевому аденозину (А) присоединяется аминокислота.
Наличие в tРНК тимина (T), псевдоуридина(
C- петле), и дигидроуридина (ДГУ) (в D-петле) - минорных, т.е. редко встречающихся в РНК нуклеотидов, указывает на особенности ее строения, необходимые для безошибочного узнавания ферментами, для защиты от действия рибонуклеаз (поэтому tРНК - долгоживущие, в отличие от mРНК).

Третичная структура в проекции на плоскость имеет форму бумеранга.
Разнообразие первичных структур tРНК - 61+1 - по количеству кодонов (соответственно числу антикодонов в tРНК) + формилметиониновая tРНК, у которой антикодон такой же, как у метиониновой tРНК.
Разнообразие третичных структур - 20 (по количеству аминокислот).
Рекогниция
Определение: рекогниция - это подготовительный этап трансляции, суть которого в образовании ковалентной связи между tРНК и соответствующей аминокислотой.
Состоит из двух стадий:
1. Активирование аминокислоты.
2. Присоединение аминокислоты к tРНК - аминоацилирование.
Обе стадии рекогниции осуществляются ферментом аминоацил-tРНК-синтетазой
|
|
|
(APC-азой, кодазой).
Существует 20 вариантов кодаз (по числу аминокислот). У каждой кодазы 3 центра опознавания. Каждая АРС-аза узнает третичную структуру tРНК.

tРНК, имеющие разную первичную, но одинаковую третичную структуру, акцептируют одну и ту же аминокислоту и называются изоакцепторными tРНК.
Есть особая tРНК, которая называется формилметиониновой tРНК. Она узнается метиониновой кодазой, соединяется с метионином и уже после реакции аминоацилирования метионин формилируется специальным ферментом, который узнает эту особую форму tРНК.
Именно с формилметионина начинается синтез любого полипептида у прокариот.

Следующий этап трансляции - собственно синтез полипептидов, происходит на рибосомах.
Структура рибосом
Рибосомы - немембранные самые мелкие клеточные органеллы, при этом они едва ли не самые сложные. В клетке E. сoli присутствует около 103-5х103 рибосом. Линейные размеры прокариотической рибосомы 210 х 290 Å. У эукариот - 220 х 320 Å.
Выделяют четыре класса рибосом:
1. Прокариотические 70S.
2. Эукариотические 80S.
3. Р ибосомы митохондрий (55S - у животных, 75S - у грибов).
4. Рибосомы хлоропластов (70S у высших растений).
Определение: S - коэффициент седиментации или константа Сведберга. Отражает скорость осаждения молекул или их компонентов при центрифугировании, зависящую от конформации и молекулярного веса.
Каждая рибосома состоит из 2-х субъединиц (большой и малой).
Сложность объясняется тем, что все элементы рибосом представлены в одном экземпляре, за исключением одного белка, присутствующего в 4 копиях в 50S субъединице, и не могут быть заменены.
rРНК выполняют не только функцию каркасов субъединиц рибосом, но и принимают непосредственное участие в синтезе полипептидов.
23S rРНК входит в каталитический пептидилтрансферазный центр, 16S rРНК необходима для установки на 30S субъединице инициирующего кодона mРНК, 5S rРНК - для правильной ориентации аминоацил-tРНК на рибосоме.
Все rРНК обладают развитой вторичной структурой: около 70% нуклеотидов собрано в шпильки.
|
|
|
rРНК в значительной степени метилированы (СН3-группа во втором положении рибозы, а также в азотистых основаниях).
Порядок сборки субъединиц из rРНК и белков строго определен. Субъединицы, не соединенные друг с другом, представляют собой диссоциированные рибосомы. Соединенные - ассоциированные рибосомы. Для ассоциации нужны не только конформационные изменения, но и ионы магния Mg2+ (до 2х103 ионов на рибосому). Магний нужен для компенсации отрицательного заряда rРНК. Все реакции матричного синтеза (репликация, транскрипция и трансляция) связаны с ионами магния Mg2+ (в меньшей степени - марганца Mn2+).
Каталитические центры рибосом
Синтез полипептидов на рибосоме
У прокариот перед каждым геном и соответственно в mРНК перед копией каждого гена имеется лидерная последовательность.
Асп - центр специфического узнавания.
Здесь происходит взаимодействие кодон-антикодон.
Р-центр - пептидильный, донорный.
Он является донором формилметионина при инициации, или пептидила при элонгации трансляции.
А-центр - аминоацильный, акцепторный.
Акцептирует формилметионин в самом начале или пептидил при элонгации трансляции.
К-центр - каталитический (фермент
пептидилтрансфераза).
В К-центре задействована 23S rРНК и несколько белков большой субъединицы.
К малой субъединице, на которой уже находится mРНК, подходит формилметиониновая tРНК, соединенная с формилметионином.
В результате образуется инициаторный комплекс:
30S субъединица рибосомы + mРНК + формилметионовая tРНК-формилметионин.
Затем происходит ассоциация рибосомы. При этом изменяется конформация 16S rРНК и нарушается связь между ней и последовательностью Шайна-Дальгарно.

Аминоацильный конец формилметиониновой tРНК оказывается в Р-центре. Второй кодон гена оказывается в Асп-центре. Соответствующая ему аминоацил-tРНК устанавливается таким образом, что ее аминоацильный конец попадает в А-центр.

Пептидилтрансфераза отрывает формилметионин в Р-центре и переносит его в А-центр. Образуется пептидная связь между формилметионином и аминоацил-tРНК.

Рибосома претерпевает конформационные изменения и сдвигается на один кодон. Формилметиониновая tРНК покидает рибосому. Второй кодон оказывается напротив Р-центра. Сюда же переходит tРНК, несущая на хвосте дипептид. В Асп-центр попадает третий кодон, а в А-центр очередная аминоацил-tРНК.

Теперь в Р-центре отрывается дипептид, переносится в А-центр и соединяется с третьей аминоацил-tРНК. Так продолжается до тех пор, пока в Асп-центр не приходит терминирующий кодон. Полипептид отрывается в Р-центре, переносится в А-центр и, т.к. присоединиться ему не к чему, он отваливается от рибосомы. Рибосома диссоциирует и малая субъединица сканирует mРНК.
|
|
|

In vivo на каждой стадии (образования инициаторного комплекса, инициации, элонгации и терминации) участвуют различные белковые факторы, которые препятствуют посадке на рибосому деацилированных tРНК или запрещают посадку формилметиониновой-tРНК в А-центр.
На всех этапах принимают участие молекулы ГТФ, которые дефосфорилируются.
Смысл гидролиза ГТФ не в отдаче энергии, а в свидетельстве того, что данный этап трансляции пройден.

Все синтезируемые полипептиды прокариот на N-конце несут формилметионин.
В 20% случаев он отщепляется, а в 80% отщепляется только формильная группа и на N конце остается метионин.
|
|
|


