 |
Специфические реакции кислот
|
|
|
|
Кислоты, обладающие сильными окислительными свойствами HNO3 (концентрированная и разбавленная), H2SO4 (концентрированная) взаимодействуют как с металлами, стоящими в ряду напряжений до водорода, так и с металлами, стоящими после Н2. Характер продукта восстановления кислоты определяется концентрацией кислоты, активностью металла и температурой.
Cu + 2H2SO4  CuSO4 + SO2↑+ H2O
CuSO4 + SO2↑+ H2O
конц.
4Ca + 5H2SO4→4CaSO4+ H2S↑ + 4 H2O
конц.
4Ba +10HNO3→4Ba(NO3)2+N2O↑+ 5H2O 
конц.
Ag + 2HNO3→AgNO3 + NO2↑ + H2O
разб.
4Ca+10HNO3→4Ca(NO3)2+NH4NO3+3H2O
разб.
Соли
Солями называют соединения, состоящие из положительно заряженных ионов (катионов) и отрицательно заряженных ионов (анионов).
Классификация солей
По составу соли можно разделить на следующие группы:
· Средние соли;
· Кислые соли;
· Основные соли;
· Двойные соли;
· Кристаллогидраты;
· Комплексные соли.
Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислотах на атомы металла или гидроксид - ионов на кислотные остатки:
H3PO4 + 3NaOH = Na3PO4 + 3H2O или
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Na3PO4 (фосфат натрия) и FeCl3 (хлорид железа) – средние соли.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода в кислотах на атомы металла. В молекулах кислых солей всегда есть незамещенные атомы водорода. Одноосновные кислоты кислых солей не образуют.
H3PO4 + NaOH = NaH2PO4 + H2O (дигидрофосфат натрия)
H3PO4 + 2NaOH = Na2HPO4 + 2H2O (гидрофосфат натрия)
Для названия кислых солей к аниону добавляют приставку гидро-, а если необходимо, то с соответствующим числителем: дигидро-, тригидро- и т.д.
Основные соли можно рассматривать как продукты неполного замещения гидроксид-ионов на кислотные остатки. В молекулах основных солей всегда есть незамещенные гидроксид-ионы. Однокислотные основания основных солей не образуют.
|
|
|
Al(OH)3 + HCl = Al(OH)2Cl + H2O (дигидроксохлорид алюминия)
Al(OH)3 + 2HCl = AlOHCl2 + 2H2O (гидроксохлорид алюминия)
Для названия основных солей к аниону добавляют приставку гидроксо-, а если необходимо, то с соответствующим числителем: дигидроксо-, тригидроксо- и т д.
Двойные соли можно рассматривать как смеси двух солей: глауберит - Na2SO4×CaSO4; глазерит - Na2SO4×3K2SO4; криолит - 5NaF×3AlF3. В растворах эти соединения ведут себя как смесь растворов соответствующих солей. Диссоциацию таких солей можно представить следующими уравнениями:
Na2SO4×CaSO4 «2Na+ + Ca2+ + 2SO42-
Na2SO4×3K2SO4 «2Na+ + 6K+ + 4SO42-
5NaF×3AlF3 «5Na+ + 3Al3+ + 14F-
Кристаллогидраты – это соли, которые при кристаллизации из водных растворов выделяются с «кристаллизационной» водой. Многие соли являются кристаллогидратами: гипс - CaSO4×2H2O; глауберова соль - Na2SO4×10H2O; карналлит - KCl×MgCl2×6H2O;
Некоторые кристаллогидраты теряют воду при нагревании. А у отдельных кристаллогидратов переход в безводную соль сопровождается даже изменением окраски:
CuSO4×5H2O (голубой)® CuSO4×(белый)
CuCl2×2H2O (зеленый)® CuCl2 (светло-коричневый)
Комплексные соли занимают особое место среди неорганических соединений. В этих соединениях комплексные ионы (катион или анион) построены по одному и тому же принципу.
Центральный ион – комплексообразователь, окруженный лигандами (ионами или молекулами), составляет внутреннюю координационную сферу. Лигандами чаще всего бывают следующие группы: OH- (гидроксо), CN- (циано), NH3 (амино), H2O (аква) и другие. Число лигандов, связанных с центральным ионом, называют координационным числом. Координационное число для Ag+ равно 2, для Cu2+, Zn2+, Pb2+- 4, а для Fe2+, Fe3+ , Al3+, Cr3+, Ni2+, Co2+- 6. Комплексообразователь и лиганды составляют внутреннюю координационную сферу соли, которую выделяют квадратными скобками. В зависимости от того, какие группы являются лигандами, комплексные ионы могут приобретать положительный или отрицательный заряд или быть электронейтральными: [Cu(NH3)4]2+, [Al(OH)6]3-, [Ag(NH3)2]+, [Pt(NH3)2Cl2].
|
|
|
За скобками справа или слева, в зависимости от заряда комплексного иона, помещают противоионы, образующие внешнюю координационную сферу. Если комплексный ион имеет положительный заряд, то противоионы располагают справа от него: [Cu(NH3)4]Cl2, [Ag(NH3)2]OH, а если отрицательный заряд – слева: Na3[Al(OH)6].
Противоионы внешней сферы связаны с внутренней сферой ионной связью – при растворении в воде происходит полная диссоциация:
Na3[Al(OH)6] «3Na+ + [Al(OH)6]3-
Частицы внутренней координационной сферы диссоциируют по типу слабых электролитов:
[Al(OH)6]3- «[Al(OH)5]2- + OH-
[Al(OH)5]2- «[Al(OH)4]- + OH-
[Al(OH)4]- «[Al(OH)3] + OH-
[Al(OH)3] «[Al(OH)2]+ + OH-
[Al(OH)2]+ «[Al(OH)]2+ + OH-
[Al(OH)]2+ «Al3+ + OH-
При названии комплексных солей, так же, как и при названии других солей, сначала называют анион, а затем катион.
Na3[Al(OH)6] - гексагидроксоалюминат натрия;
K3[Fe(CN)6] – гексацианоферрат (III) калия;
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди (II);
Химические свойства солей
При химических реакциях солей проявляются особенности как катионов, так и анионов, входящих в их состав.
· Химические свойства солей обусловлены их реакциями с металлами и неметаллами, оксидами, кислотами и гидроксидами.
· Многие химические соли при нагревании разлагаются:
| NH4NO3 = N2O + 2H2O NH4NO2 = N2 + 2H2O 2KNO3 = 2KNO2 + O2 2AgNO3 = 2Ag + 2NO2 + O2 2NaHCO3 = Na2CO3 + H2O + CO2 Ca(HCO3)2 = CaCO3 + CO2 + H2O | 2KClO3 = 2KCl + 3O2 (кат. MnO2) 4KClO3 = KCl + 3KClO4 2KMnO4 = K2MnO4 + MnO2 + O2 2FeSO4 = Fe2O3 + SO2 + SO3 4FeSO4 = 2Fe2O3 + 4SO2 + O2 4Na2SO3 = Na2S + 3Na2SO4 |
Процесс взаимодействия солей с водой называют гидролизом солей. Все соли можно разделить на четыре типа.
1. Соли сильного основания и сильной кислоты
| Например: NaCl ® Na+ + Cl- Гидролиз не идет, т.к. в этом случае должны были бы образоваться сильные электролиты NaOH и HCl |  Na+ + HOH ®
NaOH ® Na+ + OH-(гидролиз не идет) Na+ + HOH ®
NaOH ® Na+ + OH-(гидролиз не идет)
 Сl- + HOH ® Сl- + HOH ®
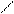 HCl ® H+ + Cl-гидролиз не идет) HCl ® H+ + Cl-гидролиз не идет)
|
2. Соли слабого основания и сильной кислоты
| Например: CuCl2 ® Cu2+ + 2Cl- При гидролизе солей, образованных слабыми основаниями и сильными кислотами, раствор приобретает кислую реакцию среды. По второй ступени: CuOH+ + HOH Û Cu(OH)2¯ + H+ гидролиз практически не идет | Cu2+ + HOH Û CuOH+ + H+
Гидролиз идет, т.к образуется слабодис-социирующее соединение CuOH+.
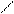 Сl- + HOH ®
(гидролиз не идет)
Cуммарно:
CuCl2 + HOH Û CuOHCl + HCl Сl- + HOH ®
(гидролиз не идет)
Cуммарно:
CuCl2 + HOH Û CuOHCl + HCl
|
3. Соли сильного основания и слабой кислоты
|
|
|
| Например: Na2CO3 = 2Na+ + CO32- При гидролизе солей, образованных сильными основаниями и слабыми кислотами, раствор приобретает щелочную реакцию среды. По второй ступени: HCO3-+ HOH Û H2CO3 + OH- гидролиз практически не идет |  Na+ + HOH ®
(гидролиз не идет)
СO32- + HOH Û HCO3- + OH-
Гидролиз идет, т.к образуется слабодис-социирующее соединение HCO3-Cуммарно:
Na2CO3 + HOH Û NaHCO3 + NaOH Na+ + HOH ®
(гидролиз не идет)
СO32- + HOH Û HCO3- + OH-
Гидролиз идет, т.к образуется слабодис-социирующее соединение HCO3-Cуммарно:
Na2CO3 + HOH Û NaHCO3 + NaOH
|
4.Соли слабого основания и слабой кислоты
| Например: Al2S3 = 2Al3+ + 3S2- При гидролизе солей, образованных cлабыми основаниями и слабыми кислотами, гидролиз протекает необратимо. | 2Al3+ + 6HOH Û 2Al(OH)3¯ + 6H+ Гидролиз идет, т.к образуется слабодиссоциирующее соединение Al(OH)3. 3S2- + 6HOH Û 3H2S + 6OH- Гидролиз идет, т.к образуется слабодиссоциирующее соединение H2S. H+ + OH- ® HOH Al2S3 + 6HOH = 2Al(OH)3¯+ H2S |
|
|
|


