 |
Тема 7. Катализ на металлах. Синтез аммиака
|
|
|
|
Раздел 4. Практика гетерогенного катализа
Микрокинетическое моделирование синтеза аммиака на железном катализаторе
Схема реакции и выражение для скорости реакции
Первым шагом микрокинетического моделирования является составление набора всех возможных элементарных стадий исследуемой реакции, которые могут быть вовлечены в каталитический процесс. В рассматриваемом случае синтеза аммиака полная реакция выглядит так
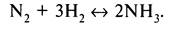
Сейчас мы составим список элементарных стадий и решим, какие из них лимитируют скорость реакции, а какие идут в состоянии квазиравновесия. Для синтеза аммиака считается общепринятым, что лимитирующей стадией является диссоциация N2; мы используем это предположение в нашем рассмотрении. Что касается квазиравновесных стадий, то дифференциальное уравнение вместе с условием равновесия позволяют выразить степени заполнения поверхности участниками реакции через парциальные давления реагентов, константы равновесия и степени заполнения поверхности другими интермедиатами.
Элементарные стадии в кинетической модели синтеза аммиака выглядят так:

Степени заполнения поверхности для всех адсорбированных соединений (которые, конечно, не обязательно могут быть измерены экспериментально) могут быть теперь выражены через константы равновесия и парциальные давления. Результат таков
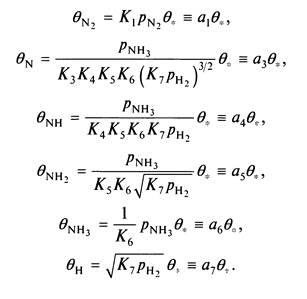
Долю свободных центров можно определить из условия, что сумма всех степеней заполнения равна единице, следовательно,
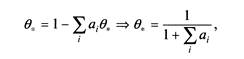
где коэффициенты ai зависят только от констант равновесия и парциального
давления.
Возвращаясь к полной реакции, находим
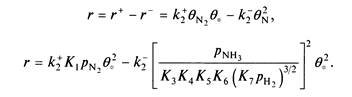
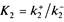 Введя константы
Введя константы
|
|
|
 и
и
получим
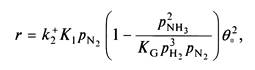
где выражение в скобках показывает, насколько реакция удалена от равновесия, а множитель перед скобками равен скорости реакции при нулевой конверсии. Отметим, что скорость реакции пропорциональна квадрату доли свободных центров.
Энергия активации и порядки реакции
Используя зависимости,

можно также получить выражения для таких наблюдаемых параметров, как порядок реакции:
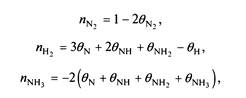
и кажущаяся энергия активации
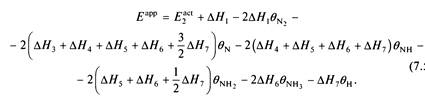
Оценка констант, коэффициента прилипания и степени заполнения поверхности.
Скорость синтеза аммиака может быть легко найдена при известных (или оцененных) значениях констант равновесия и коэффициента к2. При наличии такой возможности следует брать экспериментальные значения констант равновесия. Например, можно измерить количество атомарного азота на поверхности Fe и тем самым определить произведение к2К1.
Скорость прямой реакции может быть записана с использованием теории переходного состояния так
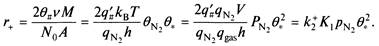
Или вводя величину коэффициента прилипания
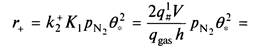
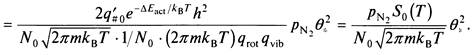
Следовательно, скорость прямой реакции может быть выражена через кажущуюся константу скорости к2К1, которая, в свою очередь, выражается коэффициент прилипания.
Коэффициент прилипания может быть рассчитан с учетом статистических сумм переходного состояния, вращательной и колебательной энергий молекулы азота, если известна энергия активации.
Для расчета используется зависимость коэффициента прилипания от температуры

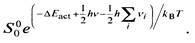
При 500 К предэкспоненциальный множитель равен Sо = 1,49х10-5.
Найденная таким образом энергия активации оказалась равной 0,1 эВ.
Далее с использованием результатов термопрогаммируемой десорбции азота с поверхности железа найдена энергия десорбции и рассчитана степень заполнения поверхности катализатора атомами азота. Найдено, что вплоть до очень высоких температур, поверхность, контактирующая с газообразным N2, в значительной мере покрыта атомами азота.
|
|
|
Синтез аммиака в рабочих условиях
На рис. 1 приведены данные, отвечающие синтезу аммиака на реально катализаторе в реакторе. Видно, что поверхность преимущественно покрыта атомарным азотом и интермедиатом NH. Такое состояние поверхности приводит к торможению реакции при высоких давлениях аммиака.
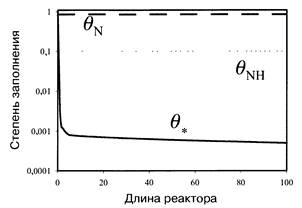
Рис.1. Доли свободных центров и центров, занятых атомарным азотом и NH, на поверхности активированного калием железного катализатора синтеза аммиака как функции длины реактора при температуре 673 К, давлении 100 бар и концентрации аммиака, соответствующе 68 % от равновесного значения

Рис. 2. Сравнение расчетных и экспериментальных значений скорости синтеза при различных давлениях. Обратите внимание на хорошее согласие теории и эксперимента, указывающее на соответствие модели и эксперимента
На рис. 2 приведена зависимость расчетного выхода аммиака из реактора от экспериментально измеренного. Видно, что микрокинетическая модель хорошо соответствует экспериментальным данным.


Паровая конверсия метана
В настоящее время конверсия метана и его гомологов является основным промышленным методом получения водорода и технологических газов для синтеза аммиака, спиртов и других продуктов.
В производстве аммиака конверсию природного газа осуществляют в две ступени: на первой ступени проводят паровую конверсию в трубчатых печах, но второй – паровоздушную конверсию остаточного метана в шахтных печах.
Паровая конверсия метана как основной метод получения водорода, интенсивно изучается также с точки зрения создания источника водорода для топливных элементов легковых электромобилей. Предполагается, что непосредственно в автомобиле будет устанавливаться каталитический реактор для получения водорода, который затем будет поступать в электрохимическую ячейку.
Наиболее распространенным описанием процесса конверсии метана с водяным паром без учета образования кокса являются суммарные уравнения

Ранее авторами А.А. Хоменко и др. был рассмотрен механизм процесса конверсии метана и получено уравнение скорости реакции [3]. Для объяснения полученных данных по кинетике реакции метана с водяным паром и конверсии оксида углерода (II) был рассмотрен следующий механизм реакции:
|
|
|
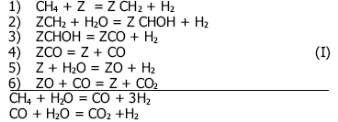
Здесь Z - свободное место на поверхности никеля, принимаемое двухвалентным, а ZСН2, ZCHOH, ZCO и ZO -хемосорбированные радикалы - СН2, СHOH, молекула оксида углерода и атомарный кислород соответственно.
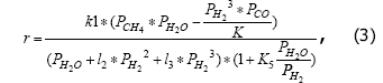
где r - наблюдаемая скорость расходования метана (моль СН4/с/м3 катализатора); k1 - константа скорости (моль СН4/с/м3 катализатора) первой стадии механизма (I); PCH4, PH2, PH2O, PCO - приведенные парциальные давления соответствующих веществ: K – константа равновесия реакции (1), l2, l3 - комплексы констант элементарных стадий, K5 - константа равновесия пятой стадии механизма I.
Уравнение (3) может быть получено не только из механизма (I). Ряд авторов разрабатывал карбидную теорию каталитических синтезов углеводородов из оксида углерода и водорода. Исходя из этой теории, механизм (I) должен быть заменен следующим механизмом, включающим в качестве промежуточного вещества поверхностный углерод:
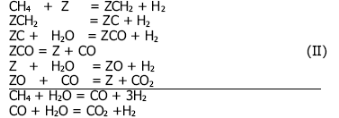
Рассмотрение механизма (II) приводит к кинетическому уравнению:
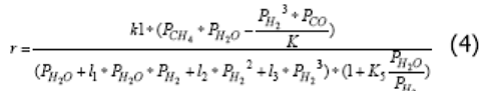
Механизм процесса (I) не учитывает наличие кокса на поверхности катализатора. Для оценки влияния кокса на поверхности катализатора необходимо включить в рассмотрение маршруты, связанные с образованием и расходованием углерода. Кроме реакций (1) и (2) данный процесс может включать в себя следующие стадии:

С учетом того, что исходная смесь содержала только метан и водяной пар для описания процесса были выбраны реакции(7), (8) и (2). Таким образом, процесс представляет собой дегидрирование метана до углерода и водорода с последующей газификацией углерода паром и конверсии оксида углерода (II)
Для стадий (7) и (8) был принят следующий вид уравнений скорости:

где U1 и U2 - скорости реакций (7) и (8) соответственно, (моль / с / м3); k1 и k2 - константы скорости реакций (7) и (8) соответственно, (моль / с / м3);PCH4, PH2, PH2O, PCO - парциальные давления соответствующих веществ; Кр1 и Кр2 - константы равновесия реакций (7) и (8) соответственно; α -степень заполнения поверхности катализатора углеродом. В стационарном режиме функционирования катализатора скорости накопления (9) и расходования (10) углерода равны, что позволяет исключить из рассмотрения величину α. Подстановка выражения для степени заполнения поверхности α, полученного из уравнения (10) в уравнение (9) дает окончательный вид уравнения скорости процесса:
|
|
|

было принято, что константа скорости реакции (7) много больше константы скорости реакции (8), следовательно, слагаемые знаменателя, содержащие k2 малы по сравнению со слагаемыми, содержащими константу k1. Тогда уравнение (11) приняло вид:
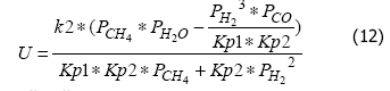
Наблюдаемые энергии активации составили для стадии (7) - 72080 Дж/моль, для стадии (8) - 82340 Дж/моль, что соизмеримо с тепловыми эффектами соответствующих стадий.
После определения констант скорости была выполнена оценка степени заполнения поверхности катализатора углеродом α. Расчет велся при разных температурах и степенях превращения метана в интервале от 0 до равновесного значения. Результаты расчета представлены на рисунке 3.

Рисунок 1. Зависимости степени заполнения поверхности
углеродом от степени превращения метана при разных
температурах проведения процесса. Индексы 0-6 отвечают
значениям температуры - 600 – 900 °С с шагом 50 °С
соответственно.
Следует отметить разный характер изменения степени заполнения поверхности катализатора углеродом по мере превращения метана при высоких и относительно низких температурах. Потеря активности катализатора вследствие коксообразования может наблюдаться при умеренных температурах.
Если рассматривать систему в состоянии равновесия, то зависимости степени превращения метана и доли заполненной углеродом поверхности от температуры будут иметь вид, представленный на рисунке 2.
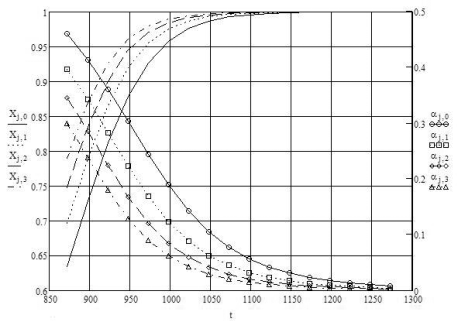
Рисунок 2 - Зависимости степени превращения метана X и доли заполненной углеродом поверхности α от температуры. Индексы 0, 1, 2, 3 отвечают значениям отношения водяной пар/углеводород - 2, 2.5, 3, 3.5 соответственно. Температура указана в градусах Кельвина
|
|
|


