 |
Уравнение состояния идеального газа
|
|
|
|
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
Национальный минерально-сырьевой университет «Горный»
Кафедра общей и технической физики
Физика
Газовые законы.
Тарировка газового термометра
Методические указания к лабораторной работе
Для студентов всех специальностей и направлений подготовки бакалавриата
САНКТ-ПЕТЕРБУРГ
2015
УДК 531/534 (075.83)
СТАТИСТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА: Методические указания к лабораторным работам / Национальный минерально-сырьевой университет «Горный» Водкайло Е. Г, Кожокарь М. Ю. С-Пб, 2015, 25 с.
Лабораторные работы по курсу физики предназначены для студентов всех специальностей и направлений подготовки бакалавриата Национального минерально-сырьевого университета «Горный».
С помощью методических указаний к лабораторным работам студент имеет возможность, в предварительном плане, ознакомиться с физическими явлениями, методикой выполнения лабораторного исследования и правилами оформления лабораторных работ.
Выполнение лабораторных работ проводится студентом индивидуально по графику.
Табл. 6. Ил. 7. Библиогр.: 7 назв.
Научный редактор доц. Н.Н. Смирнова
| © Национально минерально-сырьевой университет «Горный», 2015 г. |
ВВЕДЕНИЕ
Цель проведения лабораторных работ, как и проведения дисциплины в целом – обеспечить приобретение знаний и умений по физике в соответствии с Федеральным государственным образовательным стандартом (ФГОС) по различным направлениям подготовки специалистов и бакалавров.
|
|
|
В соответствии с требованиями ФГОС к результатам освоения дисциплины лабораторный практикум направлен на формирование компетенций заключающихся в способностях:
- организовать свою работу для достижения поставленных целей;
- применять на практике приобретенные навыки при поведении и описании исследований, в том числе экспериментальных;
- работать самостоятельно;
- использовать инновационные идеи;
- принимать участие в научно-исследовательских разработках по профилю подготовки.
Виртуальный лабораторный практикум по физике в рамках дополнения натурного эксперимента, при обеспечении требуемой точности, делает виртуальный эксперимент существенным элементом повышения качества обучения и усиления его мотивации. Кроме того, физические задачи, выраженные не только в текстовом виде, но и представленные в модельно объёмном лабораторном варианте, позволяют обучать принятию технических решений различных уровней. Это является весьма важным элементом инженерного образования.
В виртуальной лабораторной работе реальную установку имитирует системный блок компьютера. Пультом управления является клавиатура. Монитор совмещает функцию цифрового индикатора измерительных приборов и экрана для наблюдения за работой установки и изучаемыми процессами. Элементы виртуальной установки реагируют на действия пользователя, которые регламентируются методическими указаниями.
Для экспериментального изучения принципа работы тепловой машины и определения циклов её работы предлагается виртуальная лабораторная работа. Программное обеспечение работы позволяет исследовать тепловую машину и производить измерения в прямом и обратном цикле. Студенты при выполнении базовых заданий на основе экспериментальных данных определяют такие параметры как объем V, давление p, температуру Т и производят оценку работы A графически, построив график зависимости p = f (V) по результатам измерения параметров состояния газа в процессе сжатия.
|
|
|
Методика проведения измерений, обработки экспериментальных данных, оценки погрешностей прямых и косвенных измерений, а также процедура подготовки студентов к выполнению работы и защиты отчетов производится в таком же порядке, как и при выполнении работ реального физического практикума в соответствии с требованиями кафедры общей и технической физики.
- Идеальные газы
Законы идеальных газов
Идеальным называется газ, в котором отсутствуют силы межмолекулярного взаимодействия и возможно пренебрежение размерами молекул газа. Модель идеального газа с достаточной степенью точности можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по свойствам к идеальному газу.
Состояние идеального газа характеризуется переменными Р (давление), V (объем) и T (температура), которые называются термодинамическими параметрами или параметрами состояния. Процессы в газе также характеризуются величинами D Q (количество теплоты) и A (работа), определяющими энергетические процессы в системе газ-окружающая среда.
Рассмотрим процессы и законы, описывающие поведение идеального газа.
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
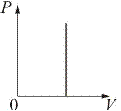
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля: при постоянном объёме и неизменных значениях массы газа и его молярной массы отношение давления газа к его абсолютной температуре остаётся постоянным:
P 1/ Т 1 = P 2/ Т 2 =… P 0/Т0 или P /Т = const. (1)
График изохорического процесса на РV-, РТ- и Vt- диаграммах называется изохорой (рис.1).
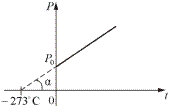
Если температура газа выражена в градусах Цельсия, то уравнение изохорического процесса записывается в виде
P = P 0(1+α t), (2)
где Р 0 – давление при 0 0С, α – температурный коэффициент давления газа равный 1/273 град -1.

| Рис. 1. Графики изохорического процесса. |
|
|
|
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака: при постоянном давлении и неизменных значениях массы и газа, и его молярной массы отношение объёма газа к его абсолютной температуре остаётся постоянным:
V 1/ T 1 = V 2/ T 2=… V 0/ T 0 или V / T = const. (3)
График изобарического процесса на РV-, РТ- и Vt- диаграммах называется изобарой (рис. 2).
Если температура газа выражена в градусах Цельсия, то уравнение изобарического процесса записывается в виде:
V = V 0(1+α t), (4)
где V 0 – объём при 0 0С, α= 1/273 град-1 –температурный коэффициент расширения.
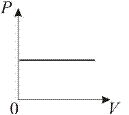

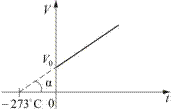
Рис. 2. Графики изобарического процесса.
Из (2) и (4) следует, что изобары и изохоры пересекают ось температур в точке t = -1/α = - 273,15 0C, определяемой из условия 1+α t = 0. Если перенести начало отсчета в эту точку, то происходит переход к шкале Кельвина, откуда T = t + 1/α.
Вводя в формулы (2) и (4) термодинамическую температуру, законам можно придать более удобный вид:
 , (5)
, (5)
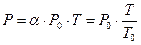 .
.
где  =273,15°К.
=273,15°К.
3. Изотермический процесс. Закон Бойля – Мариотта. T = const.
Изотермическим процессом называется процесс, протекающий при постоянной температуре Т. Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: при постоянной температуре и неизменных значениях массы газа и его молярной массы произведение объёма газа на его давление остаётся постоянным:
P 1 V 1 = P 2 V 2 =…= P 0 V 0 или PV =const. (6)
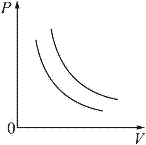
График изотермического процесса называется изотермой и изображается на PV-диаграмме в виде гиперболы (рис. 3). С повышением температуры газа изотерма удаляется от начала координат.
4. Адиабатический процесс (изоэнтропийный ΔS = 0,
S = const):
Адиабатический процесс – термодинамический процесс, происходящий без теплообмена с окружающей средой.
Уравнение адиабаты: V γP= const, где γ – показатель адиабаты.
На рис. 4. показаны график и различных изопроцессов в PV-
координатах. Как видно из рисунка, адиабата идет круче, чем изотерма.
|
|
|



5. Политропический процесс – процесс, при котором теплоёмкость
газа остаётся постоянной. Политропический процесс – общий случай всех перечисленных выше процессов.
6. Закон Авогадро: при одинаковых температурах и давлениях в равных объемах любого газа содержится одинаковое число молекул
N A = 6,022∙1023 моль -1. Следствием этого закон является то, что моли любых газов, при одинаковых температуре и давлении, занимают одинаковые объемы. При нормальных условиях объем моля равен
V μ = 22,41·10–3 м3/моль.
7. Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений Р, входящих в нее газов:
P см = P 1 + P 2 +… + P n. (7)
Парциальное давление P n– давление, которое оказывал бы данный газ, если бы он один занимал весь объем.
При P см = P 1 + P 2, ν см = m1/μ1 + m2/μ2 давление смеси газов:
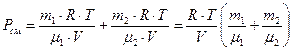 . (8)
. (8)
Где m - молярная масса газа, кг/моль; R - газовая постоянная, равная 8,31 Дж/моль×град;
Уравнение состояния идеального газа
(уравнение Менделеева–Клапейрона)
Между параметрами: давлением Р, объёмом V и температурой T существует определенная связь, называемая уравнением состояния, которое в общем виде дается выражением
f (P, V, T) = 0, (9)
где каждая из переменных является функцией двух других.
В соответствии с законами Бойля–Мариотта и Гей-Люссака, французский физик Б. Клапейрон сделал заключение, что для данной массы газа величина PV / T остаётся постоянной, т.е.
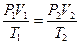 или
или 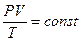 . (10)
. (10)
Русский ученый Д.И. Менделеев объединил известные законы Бойля–Мариотта, Гей-Люссака и Шарля с законом Авогадро. Уравнение, связывающее все эти законы для состояния идеального газа, называется уравнением Менделеева–Клапейронаи записывается в виде:
 , (11)
, (11)
где P - давление газа, Па; V - объем, занимаемый газом, м3; ν - количество вещества, моль; m - масса газа, кг; m - молярная масса газа, кг/моль; R - газовая постоянная, равная 8,31 Дж/моль×град; T - температура, К.
Уравнение Менделеева–Клапейрона для смеси газов:
 . (12)
. (12)
|
|
|


