 |
Рассмотрим интегральные методы
|
|
|
|
Обратите внимание в выражение для скорости простой реакции не входят концентрации продуктов реакции.
Пример из экзаменационных билетов:
1. Определите общий порядок реакции и сделайте вывод о типе реакции (простая или сложная).
r = kCA 1/2 CB 3/2
Ответ: Общий порядок n = ½ + 3/2 =2. Реакция сложная, т.к. порядки реакции имеют дробное значение
2. Кинетика фотохимического хлорирования тетрахлорэтилена в растворе
описывается уравнением:

Ответ: Реакция сложная, т.к. порядок по Cl2 имеет дробное значение
Для простых реакций молекулярность и порядок реакции совпадают.
Несовпадение молекулярности и порядка реакции имеет место в трех основных случаях:
для сложных реакций,
для гетерогенных реакций и
для реакций с избытком одного из реагирующих веществ.
Кинетическая кривая - зависимость концентрации одного из реагентов или продуктов от времени.
С i = f (t).
Вид этого уравнения зависит от порядка реакции. Кинетическую кривую можно получить путем интегрирования выражения для скорости реакции: Например
А à Пр, ni = n i =1; 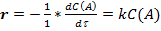
∫dCA/CA = -∫kt отсюда получим ln(CA) = ln(C0A) -kt
Время полупревращения (или полураспада) t 1/2 - это время, за которое прореагирует половина взятого исходного вещества СА=С0А/2.
Например, для реакции первого порядка оно равно:
t 1/2 = 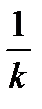
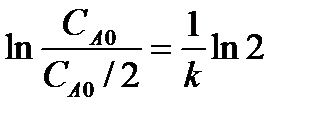 ,
,
т.е. для реакций первого порядка время полупревращения не зависит от начальной концентрации реагента. Зависимость времени полупревращения от начальной концентрации для реакций других порядков приведены в таблице.
Задачи химической кинетики
• Все задачи химической кинетики разделяются на прямые и обратные. Прямая задача химической кинетики — это расчет скорости протекания реакции на основе информации о ее механизме, константах скоростей отдельных стадий реакции и о ее начальных условиях.
|
|
|
• Обратная задача химической кинетики — это процедура определения механизма сложного процесса, констант скоростей отдельных стадий реакции на основе опытных данных.
Дальнейшая работа основана на таблице формальной кинетики.
Методы определения порядков реакции (обратная задача) – номер метода совпадает с номером столбца в таблице
Для реакции nAА+ nBВ --à Пр
1 – Метод Вант-Гоффа
2 - Метод подбора уравнений (колонки 2.1., 2.2.)
3 - Метод времен t1/2 (кол. 3):
Вспомогательные методы
4. Метод понижения порядка. (Метод понижения порядка или изолирования Оствальда)
r = kCAnaCBnb = k’CAna где k’ = kCBnb . Cправедливо, если CB0 / CA0 = 8-10 и более
Дальнейшая работа основана на таблице формальной кинетики.
| n | r= k* П Cin | Y=ax +b | График | t 1/2 | k | Примечание |
| n | r= k* П Cin | Y=ax +b | График | t 1/2 | k | Примечание |
| 0 | r = kCa0 =k | Ca=Ca0-kt | Ca=f(t) | Ca0/2k | моль/л*c | |
| 1 | r = kCa1 | lnCa=lnCa0-kt | lnCa= f(t) | ln2/k | 1/ c | |
| 2 | r = kCa2 | 1/Ca = 1/Ca0 +kt | 1/Ca = f(t) | 1/Ca0 k | л/моль*с | Ca = Cb |
| 2 | r = kCaCb | lnCa/Cb= lnCa0/Cb0 + (Ca0-Cb0) kt | lnCa/Cb= f(t) | л/моль*с | Ca ¹ Cb | |
| 3 | r = kCa3 | 1/Ca2 = 1/(Ca0)2 +2kt | 1/Ca2 = f(t) | 3/2*1/(Ca0)2 k | л2/моль2*с | Ca = Cb =Сс |
| Метод | 1 | 2.1 | 2.2 | 3 |
Задачи на семинар построены не по реакциям различного порядка, а по типу экспериментальных данных.
Для преподавателей – На семинар, лекцию и лабораторные занятия каждый студент должен иметь указанную таблицу для эффективной работы.
Таблица в электронном виде будет разослана в каждую группу.
Рассмотрим интегральные методы
|
|
|
2 метод – метод подбора уравнений
Метод реализуется в двух вариантах – аналитическом и графическом.
Аналитический метод подбора уравнения заключается в том, что мы предлагаем общий порядок реакции (n) и выбираем необходимое уравнение (колонка 2.1 в таблице)
Критерием правильности выбора порядка реакции является расчет нескольких значений k и если они близки в пределах ошибки (k = const), то порядок выбран правильно. В противном случае выбираем новый порядок (n) и заново повторяем процедуру.
Пример решения разобран ниже.
Графический метод подбора уравнения (точнее метод спрямляющих координат) заключается, что для выбранного порядка строится график прямой линии в спрямляющихся координатах. Правильно выбранный порядок (n) отвечает лучшей линейной зависимости.
Пример 1. Кинетическая кривая для реакция между эквивалентными концентрациями А В при 24,8оС описывается следующими данными:
А + В à Пр
| t, мин | 0 | 114 | 273 | 405 | 662 | 1388 |
| [I2], моль/л | 0,0251 | 0,0213 | 0,0177 | 0,0155 | 0,0124 | 0,0079 |
Определите среднее значение константы скорости реакции и время полупревращения
Решение:
Предложим, что возможные порядки реакции n – 1 или 2. Из данных видно, что при
| t = 0 C0A=0,0251. |
Из таблицы (кол. 2.1) n= 1; ln(CA) = ln(C0A) –k1t отсюда k 1 = [ ln (CA)/(C 0 A)]/ t n=2; 1/ CA = 1/ CA 0 +k2t для CA = CВ отсюда k 2 = [ 1/ CA - 1/ CA 0 )]/ t
рассчитает новые координаты ln(CA) и 1/ CA значения k для каждого t
| t, мин | 0 | 114 | 273 | 405 | 662 | 1388 |
| [А], моль/л | 0,0251 | 0,0213 | 0,0177 | 0,0155 | 0,0124 | 0,0079 |
ln(CA) -3,685 -3,849 -4,034 -4,167 -4,390 -4,841
k1*103 1,44 1,28 1,19 1,07 0,83
1/ CA 39,84 46,95 56,50 64,52 80,65 126,58
k2*102 6,23 6,10 6,09 6,16 6,25
Найденные значения (аналитический метод) показывают постоянство k = 6,17*10-2 л/ моль*м для n=2. В то время как для k1 наблюдается ее уменьшение при увеличении времени.
|
|
|
График линейной зависимости также подтверждает 2 порядок реакции:

Для линейного графика критерием выбора порядка реакции является квадрат коэффициента корреляции R2
Чем выше значение коэффициента R2, тем лучше прямая.
Уравнение прямой представлено на графике У = kx +b
Тангенс угла наклона tga = k = 0,0625
Определив порядок реакции, можно найти время полупревращения (кол 3 в таблице)
t 1/2 = 1/(kCA 0) = 1/( 6,25*10-2*0,0251) = 645 мин
Выражение для скорости реакции r = kCa 2
Решенная задача представляет 1 тип кинетических данных – для реакции известны как начальные концентрации реагентов, так и зависимости изменения концентрации исходных веществ от времени.
Алгоритм решения в общем виде:
Решение: 1. Предполагаем порядок простой реакции = nI.
2. Записываем выражение для скорости реакции
3. Выбираем из таблицы интегральное выражение для данной реакции
4. Находим k по крайней мере для трех точек и подтверждает правильность
выбора порядка реакции и затем находим t 1/2
2 тип кинетических данных– для реакции: Даны только начальные концентрации реагентов и зависимость изменения концентрации только одного из участников реакции от времени.
Пример 2.
Для газофазной реакции
N2O5 = N2O4 + ½ O2
При 25оС получены следующие опытные данные:
t, мин………,,0 20 30 40 50 60 ¥
Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000
Определить порядок реакции, значение константы скорости, время полупревращения и записать выражение для скорости реакции
Как видно из экспериментальных данных в задаче имеется только информация о кинетической кривой продукта реакции О2, в то время как нам необходима информация о кинетической кривой исходного N2O5 . Для связи концентраций между собой используем уравнение материального баланса (МБ).
Уравнение материального баланса (МБ) в общем виде имеет вид:
Сi = Coi ± (ni/nст)*хст,
где nст и хст – стехиометрический коэффициент и изменение концентрация любого вещества по которому есть информация в задаче.
|
|
|
± относится к типу вещества – исходное (-) и конечное (+)
Уравнение материального баланса справедливо и для числа молей
ni = noi ± (ni/nст)*хст
и для давления: Рi = Рoi ± (ni/nст)*хст
Алгоритм решения:
1. Предполагаем порядок простой реакции = nI.
2. Записываем выражение для скорости реакции
3. Выбираем из таблицы интегральное выражение для данной реакции
4. Используя уравнения материального баланса находим зависимость
концентрации всех исходных реагентов от времени
5. Находим k по крайней мере для трех точек и подтверждает правильность
выбора порядка реакции и затем находим t 1/2
Решение
По уравнению МБ запишем выражение для давления N2O5 :
хст = хО2 и Р(N2O5) = Р0(N2O5) - (1/½)*хО2 = Р0(N2O5) - 2*хО2 .
Аналогично: Р(О2) = Р0(О2) - (½/½)*хО2 = Р0(О2) - *хО2 .
По условию задачи: Р0(О2) = Р(О2) при t = 0 и следовательно Р0(О2) = 0
В задаче отсутствует значение Р0(N2O5), которое тоже можно найти из МБ.
При бесконечно большом времени Р(N2O5) = 0 (весь реагент прореагировал), тогда
Р¥(N2O5) = Р0(N2O5) - 2*х¥О2 = 0 отсюда Р0(N2O5) = 2*х¥О2 =2*5 = 10 атм
Окончательно имеем уравнение связи:
Р(N2O5) = Р0(N2O5) - 2*хО2 = 2*х¥О2 - 2*хО2. Полученные данные запишем в таблицу
t, мин………, 0 20 30 40 50 60 ¥
Р(О2), атм…… 0 0,821 1,237 1,640 2,051 2,470 5,000
Р(N2O5), атм 10 8,358 7,526 6,720 5,898 5,060
Допустим, что n =0. Из таблицы кол. 2.1 à Р(N2O5) = Р0(N2O5) - kt, значит график в координатах Р(N2O5) = f(t) должна быть прямая линия.
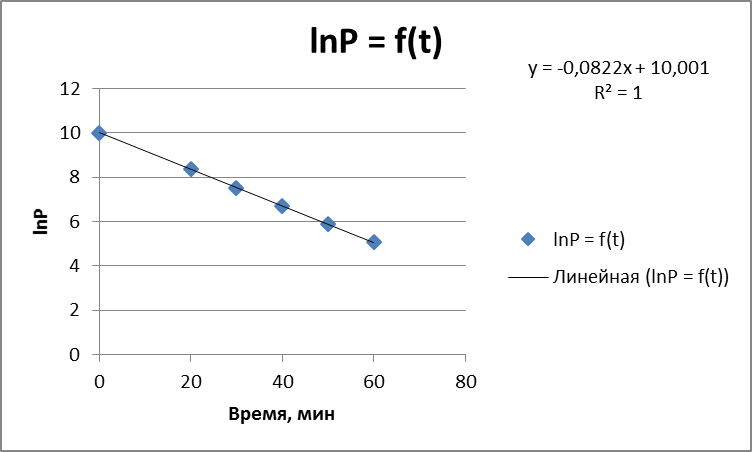
Тангенс угла наклона tga = - k = -0,0822 и k = 8,22*10-2 1/мин
Время полупревращения t 1/2 = Р A 0 /2 k = 10/2* 8,22*10-2 = 60,83 мин
Выражение для скорости реакции r = k Р0 = k
|
|
|


