 |
Метод избыточных концентраций
|
|
|
|
Задачи на метод времен полупревращения
Метод времен полупревращения работает не только для целочисленных порядков, но и для любых n. Время полупревращения это время за которое расходуется половина исходного соединения, т.е. при τ = τ 1/2 , СА = С0А/2.
Применим это выражение для любого интегрального уравнения n- порядка.
Например, для n = 0 в уравнение СА = С0А – k τ подставим τ = τ 1/2 , СА = С0А/2:
С0А/2 = С0А – k τ 1/2 , отсюда τ 1/2 = С0А/2 k.
Аналогично получим выражение для других порядков.
Из анализа таблицы мы можем получить общее выражение
τ 1/2 =  = const*
= const* 
Это уравнение прямой в логарифмических координатах (рис.1), т.е. можно применить графический метод времен полупревращения:
 =
= 
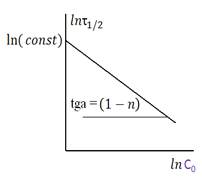

Если мы имеет два опыта (рис 2) по определению τ 1/2 можно применить а налитический метод.
 =
=  ;
;
Задача 1. Изучалось гетерогенное разложение аммиака на вольфрамовой проволоке при Т = 1373 К: NН3 = 1/2N2 + 3/2 Н2
Период половины превращения (t1/2) в зависимости от начального давления аммиака Ро указан в таблице:
| Ро, мм рт, ст, | 265 | 130 | 58 | 35 |
| t1/2, мин | 7,6 | 3,7 | 1,7 | 1,0 |
 =
=  = ln(7,6/3,7)/ln(265/130) = 1,01
= ln(7,6/3,7)/ln(265/130) = 1,01
1-n = 1 следовательно n = 0
Метод Вант-Гоффа
Метод Вант-Гоффа самый не точный метод и используется обычно в начальной стадии исследования, когда о кинетике реакции ничего не известно.
Метод Вант-Гоффа использует зависимость скорости реакции от концентрации только одного из реагентов:

Это уравнение имеет вид прямой линии в логарифмических координатах:
ln(r) = ln(k) + nAlnCA
Это графический подход метода Вант-Гоффа.
|
|
|

Учитывая, что в начальный момент времени все кинетические кривые можно описать прямой линией, то можно вместо CA воспользоваться начальной концентрацией С0А. В этом случае
ln(r0) = ln(k) + nAlnC0A
и этот метод часто называют методом начальных концентраций

Если мы имеет два опыта по определению r0 для двух концентрациях C0A можно применить а налитический метод:
n = ln(r”0/r’0)/ ln(C0”A/C0’A)
Задача 2. Вычислите порядок реакции и константу скорости пиролиза диборана В2Н6 (газ) при 10оС из следующих данных по зависимости скорости реакции от концентрации диборана. Запишите выражение для скорости реакции.
| [ B2 Н6 ]0,102, моль/л , | 2,153 | 0,433 |
| г 0,104, моль/(л,час) | 7,4 | 0,73 |
Решение:
n = ln(r”0/r’0)/ ln(C0”A/C0’A) = ln(7,4/0,73)/ln(2,153/0,433) = 1,84
Полученный ответ лежит между 1,5 (сложная реакция) и 2. В первом приближении ответ ближе к n =2. Для более точного ответа надо обработать данные по второму порядку и посмотреть качество линейной зависимости (коэффициент корелляции). Дополнительно напомним, что дробный порядок сложной реакции меняется кратно ½ à ½, 3/2.
В случае, если в реакции два исходных вещества n А А + n В В à Пр и порядки по А и В неизвестны можно применить следующий подход.
1. Сравниваем два опыты в которых СВ0 = сonst и меняется СА :
r = k*CAnACBnB = k”CAnA , где k” =k*CBnB . В этом случае можно определить порядок по А.
2. Сравниваем два опыты в которых СА0 = сonst и меняется СВ :
r = k*CAnACBnB = k’CBnB , где k” =k* CAnA. В этом случае можно определить порядок по B.
Задача 3. В реакции А + В = Пр получены следующие начальные скорости при различных начальных концентрациях реагентов:
Номер опыта 1 2 3
| [А]0, моль/л | 1,0 | 0,1 | 1,0 |
| [В]0, моль/л | 1,0 | 1,0 | 0,0025 |
| r0, моль/(л ,с) | 0,025 | 0,0025 | 0,00025 |
Напишите кинетическое уравнение реакции? Определите константу скорости.
|
|
|
Решение: Cравниваем опыты 1 и 3 с [А]0 = 1 M = со nst:
nB = ln(r”0/r’0)/ ln(C0”B/C0’B) = ln(0,025/0,00025)/ln(1/0,0025) = 0,77» 1
Cравниваем опыты 1 и 2 с [ B ]0 = 1 M = со nst:
nA = ln(r”0/r’0)/ ln(C0”A/C0’A) = ln(0,025/0,0025)/ln(1/0,1) = 1
Окончательно получим r = k*CA1CB1 и из первого опыта получим:
k = r0 /CA1CB1 = 0,025 л /моль ,с)
Метод Вант – Гоффа можно применить и к кинетической кривой СА =f(τ). В этом случае для нахождения скорости проводим численное дифференцирование при котором вместо истинной скорости r0, получаем среднею скорость реакции rср.:
Ccp=  ;
; 
Задача 4. Изучалась реакция газофазного разложения пентоксида диазота А при 25ОС:
А = В + С
Методом Вант-Гоффа определите порядок реакции по изменению концентрации реагента А во времени:
| t, мин, | 0 | 20 | 100 | 120 | 200 | 220 | 300 | 320 |
| С (А), моль/л | 0,1 | 0,096 | 0,0816 | 0,0784 | 0,0667 | 0,0640 | 0,0544 | 0,0523 |
Метод избыточных концентраций
Обработка уравнений более высокого порядка чем n = 2 при неравных концентрациях реагентов приводит к заметному усложнению интегральных уравнений. Для упрощения был введен метод избыточных концентраций.
Например для выражения скорости
r = k*CACB2 или r = k*CACB Сс
Желательно привести к уравнению только от CA:
r = k*CACB2 = r = k”CA, где k” = k*CB2
Это возможно при условии, что C0B << C0А и C0B/C0А = 8 -10
|
|
|


