 |
Обработка экспериментальных данных
|
|
|
|
Методические указания к практикуму по физической химии
Лабораторная работа №18
Изучение скорости реакции разложения мочевины в водных растворах методом электропроводности
Тверь 2006
Работа №18
Изучение скорости реакции разложения мочевины в водных растворах методом электропроводности
Цель работы: получение кинетических данных для реакции в растворе путем измерения его электропроводности с последующим аналитическим и графическим расчетом константы скорости и энергии активации.
Краткие теоретические положения
Мочевина в водных растворах при 50° изомеризуется, т.е. превращается в цианат аммония с последующим переходом из цианата в карбонат

Реакция превращения цианата в карбонат протекает практически необратимо. В результате образования карбоната электропроводность со временем растет. Это позволяет измерять скорость реакции, поскольку приращение электропроводности можно считать пропорциональным концентрации конечного продукта.
Приборы и реактивы: термостат (жидкостный), кондуктометр, пробирка, колба на 100 мл, мерная колба на 50 мл (с грузом), секундомер, мочевина.
Порядок выполнения работы
В термостат, установленный предварительно на температуру 65 °C, поместить на 20 минут колбу, содержащую 100 мл дистиллированной воды. Затем приготовить 1М раствор мочевины. На аналитических весах отвесить навеску мочевины, поместить ее в мерную колбу емкостью 50 мл и довести объем раствора в колбе до метки дистиллированной водой, выдержанной в термостате.
Время начала и конца растворения мочевины фиксировать по часам и среднее время принять за время начала реакции. В момент конца растворения включить секундомер. Колбу с раствором закрыть пробкой и поместить в термостат.
|
|
|
Сосуд для измерения электропроводности, снабженный притертой крышкой, быстро сполоснуть приготовленным раствором и заполнить этим раствором. Электроды должны быть погружены в раствор на 0,5-1 см ниже его уровня. Затем пробирку укрепит в термостате так, чтобы уровень воды в термостате был выше уровня раствора в сосуде.
Через 10-15 минут после начала реакции приступить к измерениям электропроводности, причем один из работающих производит измерения, а другой следит за секундомером и записывает показания. В течение работы необходимо произвести два-три измерения через 5 мин, четыре-пять измерений - через 10 мин, два-три измерения - через 20 мин, два-три измерения - через 30 мин и одно - через час.
Одновременно с термостатированием основного раствора другой работающий переливает оставшуюся часть исследуемого раствора в колбу, снабженную обратным холодильником, и ставит ее в водяную баню с тем, чтобы довести реакцию до конца.
Через 3-4 ч раствор охладить до температуры опыта и измерить его электропроводность. Для этого сосуд для измерения электропроводности вынуть из термостата, раствор из него вылить и заполнить его охлажденным раствором (предварительно сосуд сполоснуть данным раствором), после чего снова погрузить на 20 мин в термостат до установления температуры опыта. Электропроводность, полученную при этой температуре, записать, а оставшийся раствор сохранить для повторного кипячения, которое производится на следующий день.
На второй и третий день следует сделать по одному контрольному измерению электропроводности. Максимальное значение электропроводности (или минимальное значение сопротивления) выражается через х∞ (или R∞), т.е. соответствует электропроводности конца реакции.
Результаты промежуточных измерений, полученные после первого и последующих кипячений, для расчета константы скорости не используются и нужны только для определения конца реакции, когда электропроводность перестает меняться и принимает максимальное значение, соответствующее х∞.
|
|
|
Обработка экспериментальных данных
Результаты измерений свести в таблицу:
| № опыта | Время измерения по часам | Время от начала реакции, мин. | аτ, мм. | 1000- аτ,, мм. | Rτ, Ом. | 1/Rτ, Ом-1 | 
| 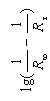
| 
| 
|
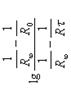
Если обозначить электрическую проводимость раствора в момент начала реакции х0, в данный момент хτ и соответствующую последнему измерению х∞ (когда она уже не меняется), тогда  :
:

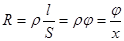 ;
;  ,
,
где φ – постоянная сосуда, ρ – удельное сопротивление, l – расстояние между электродами, S – поверхность электрода.
Тогда выражение для константы скорости принимает вид:
 .
.
Таким образом расчеты можно производить по равенству:
 .
.
Сопротивление раствора в момент начала реакции (R0) экспериментально не определяется, так как от начала реакции до первого измерения проходит некоторое время. Поэтому R0 определяют экстраполяцией, для чего строят график 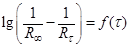 , откладывая время в минутах по оси абсцисс. Поскольку исследуемая реакция является реакцией первого порядка, экспериментальные данные в этих координатах должны укладываться на прямую. Экстраполируя полученную прямую до
, откладывая время в минутах по оси абсцисс. Поскольку исследуемая реакция является реакцией первого порядка, экспериментальные данные в этих координатах должны укладываться на прямую. Экстраполируя полученную прямую до  , находят
, находят  , а затем вычисляют R0 (рис.2).
, а затем вычисляют R0 (рис.2).

Вычислив константу скорости реакции для каждого момента, определяют среднее ее значение и сравнивают с kср, полученной графически (тангенс угла наклона к оси τ).
По константам скорости при двух температурах (вторая константа при 75 °C равна 0,00503) рассчитать энергию активации по уравнению:
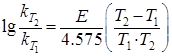 ,
,
а значение предэкспоненцильного множителя рассчитывают по уравнению:
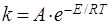
Форма отчета. Отчет должен включать в себя название работы, ее цель, краткие теоретические положения, порядок выполнения работы, таблица с опытными и расчетными данными, все требующиеся расчеты и графики (на миллиметровой бумаге).
|
|
|


