 |
Обработка экспериментальных данных
|
|
|
|
Методические указания к практикуму по физической химии
Лабораторная работа № 19
Изучение скорости реакции йодирования ацетона
Тверь 2006
Р абота № 19
Изучение скорости реакции йодирования ацетона
Цель работы: ознакомиться с методом отбора проб при изучении кинетики реакции и определить среднюю константу скорости, энергию активации и температурный коэффициент скорости реакции.
Краткие теоретические положения
Реакция йодирования ацетона протекает по уравнению
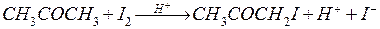
Процесс протекает автокаталитически, так как ускоряется одним из продуктов реакции (ионами водорода). В отсутствии ионов водорода (в нейтральном разбавленном водном растворе) он протекает очень медленно. Йодирование ацетона протекает в две стадии:
1) Обратимая реакция енолизации ацетона
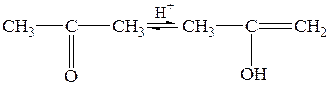
2) Взаимодействие йода с енольной формой

Первая реакция протекает медленно, вторая – быстро и практически до конца. Поэтому скорость процесса определяется скоростью энолизации ацетона, она пропорциональна концентрации водородных ионов, но не зависит от концентрации йода, т.е. уравнение для скорости и константы скорости данной реакции выглядит следующим образом:

и  , (1)
, (1)
где с0 – начальная концентрация ацетона; с0H+ – начальная концентрация ионов водорода; сx – концентрация ацетона, подвергшегося превращению за время τ (убыль концентрации); τ – время от начала реакции до данного измерения.
Ход реакции контролируется по анализу проб, периодически отбираемых из реакционной смеси.
Приборы и реактивы: термостат, мерная колба на 250 мл с пробкой, коническая колба на 200 мл, колба на 200 мл, бюретка, пипетка на 25 мл – 3 шт., раствор I2 0,1Н в 4%-ном растворе KI, раствор HCl 1Н, ацетон или 1Н раствор ацетона, раствор NaHCO3 0,1Н, раствор Na2S2O3 0,01Н, крахмал, кристаллизатор.
|
|
|
Порядок выполнения работы
Установить термостат на заданную температуру. В 250- мл мерную колбу налить 25 мл 0,1 н. раствора йода в 4%-ном растворе KI, добавить 25 мл 1 н. HCl (содержание кислоты может быть увеличено или уменьшено по указанию преподавателя) и долить водой до объема ниже метки примерно на 30-35 мл. Колбу с рабочим раствором и другую колбу с дистиллированной водой погрузить в термостат. Спустя 15-20 мин в колбу с реакционной смесью добавить примерно 1,5 г ацетона (навеску ацетона отвесить на аналитических весах в закрытом сосуде) или влить 25 мл 1н. водного раствора ацетона. Момент вливания ацетона отметить по часам. После вливания ацетона объем раствора в колбе быстро довести до метки дистиллированной водой, выдержанной в термостате, тщательно взболтать и тотчас отобрать пипеткой 25 мл пробы, отмечая этот момент по часам.
За начало реакции (τ = 0) принять время вливания ацетона в реакционную смесь. Колбу с реакционной смесью закрыть пробкой во избежание улетучивания ацетона. Отобранную пробу влить в колбу для титрования, содержащую 25 мл 0,1 н. раствора NaHCO3. Содержание йода определять титрованием 0,01 н. раствором Na2S2O3 в присутствии крахмала. За ходом реакции наблюдать по результатам анализа проб через определенные промежутки времени. Во время отбора проб колбу из термостата не вынимать. В течение опыта рекомендуется взять не менее семи-восьми проб. Вторую пробу отобрать через 10 мин после первой и по результатам титрований определить время, через которое надлежит брать следующие пробы. Расход гипосульфита на каждую последующую пробу должен изменяться на 1-3 мл.
По ходу реакции время между последовательными титрованиями постепенно следует увеличивать (например, первые три титрования проводят через 10 мин, затем два титрования – через 15 мин, еще два титрования – через 20 мин, и, наконец, одно титрование – через 25 мин). Чем выше температура, при которой производится исследование, и чем больше содержание кислоты в реакционной смеси, тем чаще следует отбирать пробы.
|
|
|
Обработка экспериментальных данных
Результаты измерений записывать в таблицу по образцу:
Температура опыта___________________
Количество 1 н. HCl __________________
| Номер измерения | Время измерения (по часам) | Время от начала реакции, мин | Количество 0,01 н. раствора Na2S2O3, мл | С0 (CH3)2CO, г-экв/л | С0H+, г-экв/л | Cx, г-экв/л | k (с указанием ее размерности) |
Концентрация ацетона cx определяется по уравнению:
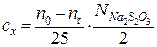 ,
,
где nτ – количество 0,01 н. Na2S2O3, израсходованное на титрование данной пробы, мл; n0 – количество 0,01 н. Na2S2O3, которое должно было быть израсходовано на титрование в момент начала реакции, мл;  – нормальность раствора.
– нормальность раствора.
Значение n0 практически определить не удается, так как от момента вливания ацетона до момента взятия первой пробы протекает значительное время. Поэтому n0 определяют по графику. Для этого на миллиметровой бумаге построить график в координатах n – τ и экстраполяцией полученной прямой до τ = 0 определить n0.
Используя расчетное уравнение (1) и значения с0, с0H+, cx и τ, вычислить константу скорости k. После этого определить величину kср и вычислить температурный коэффициент и энергию активации (значение k при другой температуре взять из справочника).
Форма отчета. Отчет должен включать в себя название работы, ее цель, краткие теоретические положения, порядок выполнения работы, таблицу с опытными и расчетными данными, все требующиеся расчеты и график определения n0 в координатах n – τ на миллиметровой бумаге.
|
|
|


