 |
Обработка экспериментальных данных
|
|
|
|
ХТ – 252
ХТ – 253
Федеральное агентство по образованию РФ
Тверской Государственный Технический Университет
Кафедра «Биотехнологии и Химии»
Методическое указание к практикуму по физической химии
Лабораторная работа № 25
«Определение температурного коэффициента ЭДС гальванического элемента и расчет его термодинамических величин»
Тверь 2013
Определение температурного коэффициента ЭДС гальванического элемента и расчет его термодинамических величин
Цель: приготовление гальванического элемента и измерение его
ЭДС при различных температурах. Вычисление температурного
коэффициента dE/dT, а также изменения энтальпии  , энтропии
, энтропии  , энергии Гиббса
, энергии Гиббса 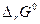 для реакции, протекающей в гальваническом
для реакции, протекающей в гальваническом
элементе.
Теоретическая часть
Обратимый гальванический элемент может быть составлен из любых двух обратимых электродов (I рода, II рода или окислительно-восстановительных). Диффузионный потенциал на границе контактирующих растворов снижают до минимума, соединяя растворы при помощи солевого мостика, наполненного насыщенным раствором KCl.
При измерениях ЭДС нужно помнить:
равновесные значения ЭДС устанавливаются не сразу, а через 3–5 мин после составления гальванического элемента;
во избежание поляризации электродов цепь можно замыкать при измерениях только на очень короткое время;
следует следить за надежностью контактов (возможно образование пузырьков воздуха на кончиках солевого мостика).
Допустим, что в гальваническом элементе квазистатически протекает реакция по уравнению:
v1 А1 + v2 А2 = v3 А3 + v4 А4,
где А1 и А2 _– исходные вещества, А3 и А4 – продукты реакции, v1 –стехиометрические коэффициенты в уравнении реакции.
|
|
|
Если в результате протекания реакции прореагирует v1 моль
вещества А1 c v2 моль вещества А2 с образованием v3 моль вещества А3
и v4 моль вещества А4, то говорят, что реакция совершила один пробег.
К этим условиям протекания реакции обычно относят наблюдаемые
в системе изменения энтальпии, энтропии и ряда других термодинамических величин.
Для квазистатического процесса при постоянном давлении и темпе-ратуре максимально полезная работа (электрическая) ( ) равна убыли
) равна убыли
энергии Гиббса (– 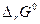 ):
):
– 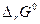 = =  = zFE. (46) = zFE. (46)
|
Из уравнения Гиббса – Гельмгольца:
 . (47) . (47)
|
Из выражения (46) следует:
 . (48) . (48)
|
При dE/dT = 0, т. е. когда ЭДС элемента не зависит от температуры, энергия реакции  (реакция экзотермическая) полностью превращается
(реакция экзотермическая) полностью превращается
в электрическую работу.
При dE/dT > 0 получаемая работа  = zFE больше энергии, освобождающейся в результате реакции. Избыток энергии черпается из окружающей среды. Если доступ тепла извне затруднен, то элемент при
= zFE больше энергии, освобождающейся в результате реакции. Избыток энергии черпается из окружающей среды. Если доступ тепла извне затруднен, то элемент при
работе охлаждается. Известны гальванические элементы, в которых протекающая реакция является эндотермической ( > 0), а dE/dT > 0.
> 0), а dE/dT > 0.
В таких элементах, очевидно, максимально полезная работа полностью производится за счет энергии окружающей среды.
При dE/dT < 0 получаемая работа меньше энергии, доставляемой реакцией; часть энергии будет выделяться в виде теплоты. Если отдача тепла элементом затруднена, то элемент при работе будет нагреваться.
Сопоставляя (48) с уравнением
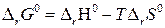 , (49) , (49)
|
легко показать, что изменение энтропии
 . (50) . (50)
|
Приборы и реактивы: установка для измерения ЭДС, солевой мостик
с насыщенным раствором KCl, электроды.
Порядок выполнения работы
В работе могут быть использованы гальванические элементы
следующих типов:
| –Hg, Zn (10%) │ ZnSO4 (нас) │ Hg2SO, Hg+, (51) –Hg, Pb (3%), PbCl2│KCl (0,1 m) │ Hg2Cl2,Hg+, (52) –Hg, Pb (3%), PbBr2│KBr (0,1 m) │ Hg2Br2, Hg+, (53) –Ag, AgCl│ KCI(нас) │ Hg2Cl2, Hg+, (54) –Zn│ ZnSO4 (нас) ║CuSO4 (нас) │Cu+ (55) |
|
|
|
Для приготовления элементов удобно использовать стеклянные сосуды, приспособленные для погружения в термостат.
Приготовление элемента (55). В крайние колена сосуда наливают насыщенные растворы ZnSO4 и CuSO4 и помещают в них укрепленные в пробках соответствующие электроды. С помощью электролитических
ключей, заполненных растворами медного и цинкового купоросов, и промежуточного сосуда с насыщенным раствором KCl электроды соединяют
в гальванический элемент.
Приготовленный элемент помещают в термостат, установленный на самую низкую из рекомендованных в задании температуру и выдерживают
в нем 15–20 мин. Собирают установку для измерения ЭДС с потенциометром
и измеряют ЭДС с точностью до ±0,5 мВ. При данной температуре
измерения повторяют несколько раз через 5–6 мин до постоянного значения ЭДС.
Аналогичные опыты проводят при других температурах с интервалами
5–10 градусов.
Обработка экспериментальных данных
Опытные данные заносят в таблицу.
Таблица 1.1. Экспериментальные и расчетные данные
| T, °С | E, В | ∆E/∆T |  , Дж/моль , Дж/моль
|  ,Дж/моль ,Дж/моль
|  ,Дж/моль ,Дж/моль
|
1. Исходя из опытных данных строят график зависимости ЭДС от температуры, на основании которого вычисляют ∆E/∆T.
2. Величины  ,
,  ,
,  вычисляют соответственно из уравнений (46), (48), (50).
вычисляют соответственно из уравнений (46), (48), (50).
Форма отчета
Отчет должен содержать название и цель работы, краткие
теоретические положения, таблица с экспериментальными данными, график зависимости ЭДС от температуры, расчеты величин  ,
,  ,
,  для
для
всех температур.
|
|
|


