 |
К методике расчета результатов измерений с газовым кулонометром
|
|
|
|
ХТ – 252
ХТ – 253
Федеральное агентство по образованию РФ
Тверской Государственный Технический Университет
Кафедра «Биотехнологии и Химии»
Методическое указание к практикуму по физической химии
Лабораторная работа № 31
«Определение чисел переноса в растворе серной кислоты»
Тверь 2013
Определение чисел переноса в растворе серной кислоты
Цель работы: определение чисел переноса ионов на основании определения количества электричества, прошедшего через раствор, и изменения содержания электролита около электродов.
Теоретическая часть
Электрохимические процессы при электролизе раствора Н2SO4. При электролизе с инертными электродами в растворе Н2SO4 происходят следующие электрохимические процессы: на катоде
2Н3О++2е– ® 2Н2О + Н2,
на аноде
3 Н2О – 2е– ® 2 Н3О+ + ½ О2.
Перенос электричества в растворе осуществляется ионами Н3О+ и SO42– (концентрация ОН– ничтожно мала):
 . .
| (65) |
Легко показать, что увеличение содержания серной кислоты в анодном пространстве при электролизе
 , ,
| (66) |
поэтому число переноса анионов можно также определить по увеличению содержания Н2SO4 в анодном пространстве:
 . .
| (67) |
Схема лабораторной установки для определения чисел переноса показана на рис. 4.
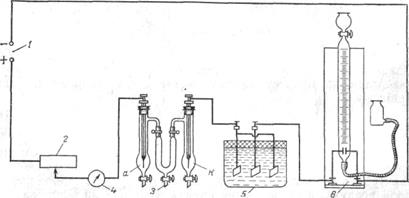
Рис. 4. Схема установки для определения чисел переноса ионов:
1 – источник постоянного тока; 2– реостат; 3– электролизер для определения чисел переноса ионов (а – анодный сосуд; к – катодный сосуд);
4 – миллиамперметр; 5 – медный кулонометр; 6– газовый кулонометр
На рис. 5 представлено устройство электролизера для определения
чисел переноса ионов.
|
|
|

Рис. 5. Электролизер для определения чисел переноса ионов:
1 – анодный сосуд; 2 – катодный сосуд; 3– соединительный сосуд;
4– зажимы; 5, 6– электроды
Поскольку при измерении чисел переноса необходимо определять изменение содержания электролита у каждого электрода отдельно, в электролизере 3анодное и катодное пространства должны быть в достаточ-
ной степени разделены. Для этой цели удобно пользоваться прибором, изображенным на рис. 5.
Количество протекающего через цепь электричества определяется с помощью кулонометров – приборов, основанных на электрохимическом принципе действия. Расчет количества электричества производится на основании законов электролиза Фарадея. Необходимыми условиями при
этом является протекание на электроде только одного электрохимического процесса, отсутствие побочных химических реакций и механических потерь продукта, т. е. электродный процесс должен проходить с выходом по току
100 %.
По методам определения количества образующихся веществ кулоно-метры подразделяются на весовые, объемные и титрационные.
Медный кулонометр (весовой) состоит из медных электродов – пластинок, погруженных в раствор CuSO4. На границе раздела электрод – электролит протекают процессы:
Сu2+ + 2е– → Сu (на катоде)
Сu – 2e–  Сu2+ (на аноде)
Сu2+ (на аноде)
Определение количества протекающего электричества eF производится по привесу катода за счет выделившейся на нем меди:
| eF = m | (68) |
где т – масса выделившейся меди, г; 31,77 – химический эквивалент меди.
Точность показаний кулонометра 0,1–0,5 %. Основными источниками погрешностей являются частичное растворение медных электродов в кислом растворе, особенно в присутствии кислорода воздуха, и образование оксида меди (I) за счет реакции на катоде
Cu2+ + е –→ Cu+
в нейтральном растворе и при малых плотностях тока, а также осаждение
меди на катоде в губчатой форме при высоких плотностях тока. Для повышения точности показаний кулонометра рекомендуется в качестве электролита использовать раствор следующего состава: CuSO4∙5H2O –
150 г/л; H2SO4 – 50 г/л; С2Н5ОН – 50 г/л; вести электролиз при умеренных плотностях тока на катоде в пределах от 2 до 20 мА∙см–2. В объемных кулонометрах количества выделяющихся на электродах веществ определяют измерением их объемов. Примером такого типа приборов является газовый кулонометр. Кулонометр состоит из градуированной бюретки, в нижний конец которой впаяны два платиновых электрода. Бюретку и уравнительную склянкузаполняют 0,5 Мраствором сульфата натрия.Для повышения точности показаний кулонометра рекомендуется перед каждым опытом насыщать раствор электролита водородом и кислородом. С этой целью собирают установку согласно рис. 4, в которую включают только один газовый кулонометр (электролизер 3и другие кулонометры не включаются) и пропускают ток 50 мА в течение 5–10 мин. Электролиз ведут при открытом кране. Затем, поднимая уравнительную склянку, заполняют газовую бюретку раствором настолько, чтобы в ней оставалось примерно 1–2 мл газа. После этого закрывают кран, уровни растворов в бюретке и склянке приводят к одной и той же высоте и
отсчитывают объем V 1оставшегося в бюретке газа. Очевидно, что давление газа в бюретке при этих условиях будет равно атмосферному. Аналогично определяется объем V 2газовой смеси и по окончании основного опыта. Разность V 2 – V 1 = V будет соответствовать объему гремучей смеси, выделившейся в кулонометре за время опыта.
|
|
|
Количество электричества определяют по формуле:
| eF = 4/3(p–h)V/(RT), | (69) |
где р – внешнее давление, мм рт. ст.; h – давление насыщенного пара воды
при температуре опыта, мм рт. ст. (см. [6], табл. 21).
Приборы и реактивы: источник постоянного тока, миллиамперметр, реостат, медный кулонометр, газовый кулонометр, электролизер для определения чисел переноса, стаканы – 2 шт., электролит для медного кулонометра, серная кислота – 1 н., азотная кислота 1: 1, едкий натр 1 н., индикатор (метиловый оранжевый).
Порядок проведения работы
При использовании медного кулонометра нужно предварительно
покрыть его катод слоем электролитической меди. Для этой цели собирают установку согласно рис. 1 без электролизера 3 и других кулонометров, помещают в медный кулонометр очищенный наждачной бумагой и промытый катод и пропускают ток 30–50 мА в течение 0,5 ч. Затем катод вынимают, промывают водой, спиртом, сушат в сушильном шкафу и взвешивают на аналитических весах.
|
|
|
После этого в установку включают другие кулонометры (согласно заданию) и электролизер с платиновыми электродами, заполненный 0,05 н. раствором Н2SO4. Электроды должны быть предварительно промыты
хромовой смесью и водой. Пропускают через цепь ток силой 20–40 мА в течение 1–1,5 ч.
За время электролиза определяют начальную концентрацию Н2SO4. Для этого берут пипеткой (10 мл) раствор кислоты и пробу титруют 0,05 н. раствором едкого натра в присутствии метилового оранжевого. По окончании опыта закрывают зажимы 4 (см рис. 5), сливают католит и анолит из электролизера в предварительно взвешенные сухие колбы, взвешивают их с раствором с точностью до 0,01 г и вычисляют массу т католита и
анолита. Для разбавленных растворов плотность принимают равной единице
и массы растворов считают совпадающими с их объемами. Затем из
каждой колбы отбирают пипеткой 2–3 пробы по 10 мл и титруют их
0,05 н. раствором едкого натра. Катод медного кулонометра после промывки
и сушки взвешивают на аналитических весах, определяют объем газа в
газовом кулонометре и определяют количество Ag+ в кулонометре Кистяковского.
Опытные данные заносят в табл. 2. Расчет чисел переноса проводят
по католиту и анолиту согласно уравнениям (67) и (69). Количество электричества еF рассчитывают по данным кулонометров согласно
уравнениям
 , ,
| (70) |
где т – масса выделившейся меди, г; 31,77 – химический эквивалент
меди;
 , ,
| (71) |
где р – внешнее давление, мм рт. ст.; h – давление насыщенного пара воды при температуре опыта, мм рт. ст. (см. [6], табл. 21);
 , ,
| (72) |
где т – масса ратсвора, г; V – объем (среднее значение) раствора KCNS, израсходованного на титрование 1 г раствора, мл; с – концентрация раствора KCNS, моль экв л–1.
|
|
|
Затем вычисляют среднее значение еF. Убыль кислоты в католите вычисляют по формуле
 , ,
| (73) |
где т – масса католита, г; V и Vk – объемы 0,05 н. раствора NaOH, израсходованного на титрование 10 мл исходного раствора Н2SO4 и
католита соответственно, мл; С – концентрация раствора Н2SO4, моль-экв*л–1. Аналогично рассчитывают  – увеличение кислоты в анолите.
– увеличение кислоты в анолите.
ВНИМАНИЕ!!!
В электролизере электроды свинцовые. Сначала следует их зачистить наждачной бумагой. Затем обработать азотной кислотой, после чего промыть дистиллированной водой.
Ток в цепи не должен превышать 100 мА. Работать следует в области
80–100 мА.
В лаборатории для измерения гремучей смеси используется не бюретка
с уравнительной склянкой, а эвдиометр.
После проведения реакции электролит для медного кулонометра в РАКОВИНУ НЕ ВЫЛИВАТЬ!
Таблица 2
Опытные данные по определению чисел переноса
| До электролиза | Католит | Анолит | |
| Масса пустой колбы, г Масса колбы с раствором, г Масса раствора т, г Расход 0,05 н. NaOH на 1-я проба титрование 10 мл раствора 2-я проба Среднее значение | |||
| Масса катода медного кулонометра После опыта, г До опыта, г | |||
Привес  т катода медного кулонометра, г
Показания газового кулонометра
После опыта, мл
До опыта, мл т катода медного кулонометра, г
Показания газового кулонометра
После опыта, мл
До опыта, мл
| |||
| Объем гремучего газа, мл |
К методике расчета результатов измерений с газовым кулонометром
Газы, выделяющиеся из раствора в результате электрохимической реакции, собираются в газовой бюретке. Эксперимент по сбору газа может выполняться в двух вариантах.
В первом варианте бюретка перед опытом целиком заполняется водой.
Во втором варианте в бюретке перед началом пропускания тока содержится газовая фаза V 1. Расчеты, производимые в результате опыта по первому и второму вариантам, несколько отличаются.
Первый вариант проведения опыта
При полном заполнении бюретки водой перед началом пропускания
тока опыт проводится с учетом следующего обстоятельства: в газе после прекращения пропускания тока над поверхностью воды в бюретке кроме водорода и кислорода (объем которых соотносится как 2: 1) находятся пары воды (рис. 6), что следует принять во внимание при подсчете давления.
Атмосферное (барометрическое давление Р атм уравновешивается давлением паров воды и высотой столба воды над уровнем ее в кристаллизаторе (h2), в который опущена бюретка (эвдиометр), и давлением смеси водорода и кислорода (Р):
 . .
| (74) |

Рис. 6. Бюретка в первом варианте проведения опыта
|
|
|
Давление для расчета должно быть выражено в одних и тех же
единицах, например, в мм. рт. ст. В случае заполнения бюретки жидкостью
или раствором с плотностью, отличной от плотности воды, равной 1
при 4 °С, необходимо умножить h 2/13,6 на плотность жидкости или
раствора, т. е.
 ; ;  , ,
| (75) |
где r – плотность жидкости (раствора).
Из уравнения (74) следует, что
 . .
| (76) |
Число эквивалентов разложившегося вещества (воды) в газовом кулонометре (е) можно рассчитать по количеству выделившегося водорода. Для газа (Н2+О2) в бюретке справедливо уравнение Менделеева – Клайперона:
| PV = nRT, | (77) |
где Р – давление газа, (Н2 + О2), мм. рт. ст.; V – объем газа, мл; R – универсальная газовая постоянная, равная 62400 мм мл/град; T – абсолютная температура, К0, n – число г-молей газа.
Из уравнения (77) следует, что
| n = PV / RT | (78) |
складывается из  и
и 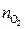 , которые находятся в соотношении 2: 3. В одном моле водорода содержится 2 г-экв водорода, поэтому в смеси водорода и кислорода содержится 4/3 эквивалентов водорода, т. е.
, которые находятся в соотношении 2: 3. В одном моле водорода содержится 2 г-экв водорода, поэтому в смеси водорода и кислорода содержится 4/3 эквивалентов водорода, т. е.
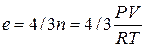 , ,
| (79) |
Подставляя в (28) уравнение (25), имеем:
 , ,
| (80) |
где 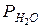 определяется температурой, при которой находится вода в бюретке (комнатная температура), и находится из таблиц.
определяется температурой, при которой находится вода в бюретке (комнатная температура), и находится из таблиц.
Второй вариант проведения опыта
Полного заполнения газовой трубки водой (или раствором) перед
опытом обычно не бывает. Остается некоторый объем воздуха с парами
воды V 1. После проведения опыта объем в газе равен V 2. В этом случае
сначала определяют давление Р 1, под которым находится воздух в бюретке перед опытом, и давление Р 2, под которым находится газ в конце опыта:
 , ,
| (81) |
 . .
| (82) |
Используя уравнение Менделеева – Клайперона, вычисляем
 , ,
| (83) |
Подставив (83) в уравнения (81) и (82), упростив и учитывая, что 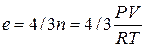 имеем:
имеем:
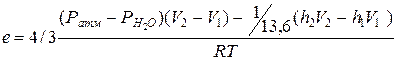 . .
| (84) |
Для расчета числа эквивалентов разложившегося вещества может быть использована формула из источника [8] для приведения выделившегося газа
к нормальным условиям:
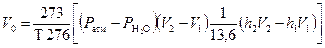 . .
| (85) |
Для получения искомой формулы необходимо иметь в виду, что объем водорода составит 2/3. Если разделить эту величину на объем водорода при нормальных условиях, соответствующих 1 г.-экв, т. е. 11200 мл, то получим:
 . .
| (86) |
С учетом сказанного, перед началом опыта необходимо измерить V 1 (мл), h 1 (мм), а после окончания опыта V 2 (мл), h 2 (мм), Р атм (мм. рт. ст.), температуру воды в бюретке (температура комнатная).
|
|
|


