 |
Прочитайте следующий текст и выполните задания 6—8
|
|
|
|
Характерные свойства веществ
Молекулярного строения
—при обычных условиях имеют жидкое, газообразное или твёрдое агрегатное состояние;
—имеют низкие значения температур кипения и плавления;
—имеют низкую теплопроводность.
Ионного строения
—твёрдые при обычных условиях;
—хрупкие;
—тугоплавкие;
—нелетучие;
—в расплавах и растворах проводят электрический ток.
Используя данную информацию, определите, какое строение имеют вещества: серная кислота H2SO4 и гашеная известь Са(ОН)2.
1. Серная кислота H2SO4
2. Гашёная известь Са(ОН)2
Сложные неорганические вещества условно можно распределять, то есть классифицировать, по четырём группам, как показано на следующей схеме. В эту схему для каждой из четырёх групп впишите пропущенные названия групп или химические формулы веществ (по одному примеру формул), принадлежащих к данной группе.

Прочитайте следующий текст и выполните задания 6—8
Серная кислота (H2SO4) является одним из основных продуктов крупно- тоннажной химии. Без неё невозможно производство удобрений, полимеров, лекарств, красителей. Ежегодно во всём мире производят примерно 220 млн тонн серной кислоты.
Разбавленная серная кислота обладает всеми общими свойствами кислот, реагирует с основаниями, основными и амфотерными оксидами, гидроксидами металлов, металлами и солями. Концентрированная серная кислота — сильное дегидратирующее средство, проявляет довольно сильные окислительные свойства и способна растворять некоторые малоактивные металлы, стоящие в ряду стандартных окислительно-восстановительных потенциалов («ряд напряжений металлов») после водорода.
В одном из способов получения серной кислоты первой стадией является обжиг пирита FeS2 в присутствии кислорода воздуха. Обжиг «в кипящем слое» ведут в печах специальной конструкции. Образовавшийся сернистый газ тщательно очищают и окисляют до оксида серы(VI), который поглощают концентрированной серной кислотой. Продукт поглощения после разбавления водой превращается в серную кислоту нужной концентрации.
|
|
|
1) В качестве примера дегидратирующего действия серной кислоты, отмеченного в тексте, приведите уравнение реакции, происходящей при действии концентрированной H2SO4 на муравьиную кислоту при нагревании.
2) Известно, что алюминий не взаимодействует с холодной концентрированной серной кислотой. Как называется это явление?
1) Запишите уравнение реакции обжига пирита на воздухе.
2) Почему печь специальной конструкции называется печью для обжига в кипящем слое»?
1) Запишите уравнение реакции, происходящей между раствором серной кисло ты и амфотерным гидроксидом алюминия, в кратком ионном виде.
2) Как называется продукт, получаемый при поглощении оксида серы(VI) серной кислотой?
Дана схема окислительно-восстановительной реакции:
HNO3 +H2S → H2SO4 + NO + Н20
1) Составьте электронный баланс для этой реакции.
2) Укажите окислитель и восстановитель.
3) Расставьте коэффициенты в уравнении реакции.
Дана схема превращений:
Аl → АlСl3 → Al(NO3)3 → Аl(ОН)3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения.
Установите соответствие между формулой органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ФОРМУЛА ВЕЩЕСТВА
А) 
Б) 
В) 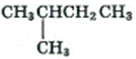
КЛАСС / ГРУППА
1) предельные углеводороды
2) альдегиды
3) непредельные углеводороды
4) карбоновые кислоты
|
|
|
В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты.
1) С3Н8 + _____ → С3Н7Вr + НВr
2) С5Н12 + _____ → СO2 + Н2O
Во многих странах этанол используют как добавку к моторному топливу, т.к. он сгорает с низким уровнем выброса токсичных веществ в атмосферу.
Какой объём кислорода (н.у.) необходим для полного сгорания 11,5 г этанола? Запишите подробное решение задачи.
Этанол широко используется в пищевой промышленности, медицине, косметической химии, а также в качестве эффективного растворителя. В соответствии с приведённой ниже схемой составьте уравнения реакций получения этанола. При написании уравнений реакций используйте структурные формулы органических веществ.

1)
2)
3)
В медицинской практике широко используется раствор хлорида кальция. Рассчитайте массу кристаллогидрата этой соли (СаСl2 * 6Н2O), которая необходима для приготовления 500 г 10%-ного раствора хлорида кальция. Запишите подробное решение задачи.
|
|
|


