 |
Водород из кислоты могут вытеснить только те металлы, которые в ряду активности стоят до водорода.
|
|
|
|
Банк вопросов по химии РК_2 _2018
1. При гидролизе кислую реакцию дает водный раствор соли:
CuSO4 SnCl2, Pb(NO3)2,
2. При гидролизе щелочную реакцию дает водный раствор соли:
1) LiCN, CH3COONa,,
3. Основную соль и кислоту образуют при гидролизе по первой ступени соли, (NH4)2CO3, CH3COONa,
4. Кислую соль и щелочь образуют при гидролизе по первой ступени соли:
MgSO4, AgNO3,
5. Гидролизу не подвергается соль: KI, NaCl,
6. pH 0,01 М раствора NaOH равен: ph= 12
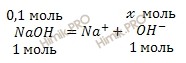 1/1=0.01/x x=0.01/1=0.01 моль
1/1=0.01/x x=0.01/1=0.01 моль
[H+] = 10-14/[OH-] = 10-14/10-2 = 10-12
 pH=-lg[10^(-12)]=12
pH=-lg[10^(-12)]=12
7. рН раствора с концентрацией ионов водорода 10-4 г-ион/л равен pH = 14-pOH = 14-(-lg 10^-4) = 1 0 (pH>7 — среда щелочная).
8. В растворе с рН=9 содержится ионов гидроксила
pOH = 14 - pH =14 - 9 = 5
[O  ] =
] =  = 10^(-5) моль/л
= 10^(-5) моль/л
9. Жесткость воды, содержащей в 100 л воды 19 г MgCl2, равна
Мэ (MgCl2) = 95 /2 = 47,5 (мг/моль)
Жвр=19/(47,5*100) *1000= 4 ммоль/л.
10. Жесткость воды, содержащей в 600 л воды 219 г Mg(HCO3)2, равна
M((1/2)*Mg(HCO3)2)=146/2=73 моль
Жвр=219/(73*600) *1000=5 ммоль/л.
11. Жесткость воды, содержащей в 500 л воды 136 г СаSO4, равна
M((1/2)*Mg(HCO3)2)=136/2=68 моль
Жвр=136/(68*500) *1000=4 ммоль/л.
12. Жесткость воды, содержащей в 1 м3 воды 140 г MgSO4, равна
M((1/2)*Mg(HCO3)2)=120/2=60 моль
1 м3=1000л
Жвр=140/(60*1000) *1000=2,33 ммоль/л.
13. Жесткость воды, содержащей в 100 л воды 14,632 г Mg(HCO3)2, равна
M((1/2)*Mg(HCO3)2)=146/2=73 моль
Жвр=14,632/(73*100) *1000=2 ммоль/л.
14. Жесткость воды, в 1 л которой содержится ионов магния 136,47 мг и ионов кальция 50,1 мг, равна
Ж (Са2+) = 50,1/(20,04. 1) = 2,5 ммоль/л;
Ж (Mg2+) = 136,47/(12,16. 1) = 11,22 ммоль/л
Ж (Общ.) = Ж (Са2+) + Ж (Mg2+) = 2,5 + 11,22 = 13,7 ммоль/л.
15. Жесткость воды, в 1 л которой содержится 146 мг Mg(HCO3)2, 243 мг Са(HCO3)2 и 111 мг CaCl2, равна
Ж (Mg(HCO3)2) = 146/(73. 1) = 2 ммоль/л;
Ж (Са(HCO3)2) = 243/(81. 1) = ммоль/л
Ж (CaCl2) = 111/(55.5 1) = ммоль/л
Ж (Общ.) = Ж (Са2+) + Ж (Mg2+) = = ммоль/л.
|
|
|
16. Для устранения постоянной жесткости, равной 10 мэкв/л на 300 л воды нужно взять Na3PO4
17. Для устранения карбонатной жесткости, равной 5,5 мэкв/л на 275 л воды нужно взять гидроксида кальция
18. Для устранения временной жесткости, равной 8 мэкв/л на 250 л воды нужно взять гидроксида кальция
19. Для устранения постоянной жесткости, равной 9 мэкв/л на 400 л воды нужно взять гидроксида кальция
20. Масса сульфата кальция, содержащегося в 300 л воды, с жесткостью 7 мэкв/л, равна
21. Масса сульфата кальция, содержащегося в 200 л воды, с жесткостью 4 мэкв/л, равна

Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu2+ → Zn2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
22. Цинк вытесняет из растворов солей металлы:, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au\
23. Железо вытесняет из растворов солей металлы: Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au
24. Магний вытесняет из растворов солей металлы Be, Al, Ti, Mn, V, Zn, Cr, Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au
25. Кадмий вытесняет из растворов солей металлы In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au
26. Медь вытесняет из растворов солей металлы Hg, Ag, Pt, O2, Au
27. Хром вытесняет из растворов солей металлы
Ga, Fe, Cd, In, Tl, Co, Ni, Sn, Pb, H2, Bi, Cu, Hg, Ag, Pt, O2, Au
Металлы, стоящие в ряду левее водорода, вытесняют водород при взаимодействии с водными растворами кислот-неокислителей; наиболее активные металлы (до алюминия включительно) — и при взаимодействии с водой.
Металлы, стоящие в ряду правее водорода, с водными растворами кислот-неокислителей при обычных условиях не взаимодействуют.
При электролизе металлы, стоящие правее водорода, выделяются на катоде; восстановление металлов умеренной активности сопровождается выделением водорода; наиболее активные металлы (до алюминия) невозможно при обычных условиях выделить из водных растворов солей.
|
|
|
Водород из кислоты могут вытеснить только те металлы, которые в ряду активности стоят до водорода.
28. Водород из растворов кислот вытесняет металлы Bi, Cu, Hg, Ag, Pt, O2, Au.
29. Водород из растворов кислот вытесняет металлы
30. Водород из растворов кислот вытесняет металлы
31. Водород восстанавливает из оксидов металлы
32. Электродный потенциал цинка, погруженного в раствор его соли 0,01 М концентрации, равен
33. Электродный потенциал магния, погруженного в раствор его соли 0,1 М концентрации, равен
34. Электродный потенциал алюминия, погруженного в раствор его соли 0,001 М концентрации, равен
35. Электродный потенциал хрома, погруженного в раствор его соли 0,001 М концентрации, равна
36. Электродный потенциал железа, погруженного в раствор его соли 0,01 М концентрации, равен
37. Электродный потенциал кадмия, погруженного в раствор его соли 0,1 М концентрации, равен
38. Электродный потенциал кобальта, погруженного в раствор его соли 0,01 М концентрации, равен
39. Электродный потенциал никеля, погруженного в раствор его соли 0,001 М концентрации, равен
Ост
| Электрод | Электродная реакция | Eo, В |
| Li+/Li | Li+ + e = Li | -3.045 |
| K+/K | K+ + e = K | -2.925 |
| Ba2+/Ba | Ba2+ + 2e = Ba | -2.906 |
| Ca2+/Ca | Ca2+ + 2e = Ca | -2.866 |
| Na+/Na | Na+ + e = Na | -2.714 |
| La3+/La | La3+ + 3e = La | -2.522 |
| Mg2+/Mg | Mg2+ + 2e = Mg | -2.363 |
| Be2+/Be | Be2+ + 2e = Be | -1.847 |
| A13+/A1 | Al3+ + 3e = Al | -1.662 |
| Ti2+/Ti | Ti2+ + 2e = Ti | -1.628 |
| Zr4+/Zr | Zr4+ + 4e = Zr | -1.529 |
| V2+/V | V2+ + 2e = V | -1.186 |
| Mn2+/Mn | Mn2+ + 2e = Mn | -1.180 |
| WO42-/W | WO42- + 4H2O + 6e = W + 8OH- | -1.05 |
| Se2-/Se | Se + 2e = Se2- | -0.77 |
| Zn2+/Zn | Zn2+ + 2e = Zn | -0.763 |
| Cr3+/Cr | Cr3+ + 3e = Cr | -0.744 |
| Ga3+/Ga | Ga3+ + 3e = Ga | -0.529 |
| S2-/S | S + 2e = S2- | -0.51 |
| Fe2+/Fe | Fe2+ + 2e = Fe | -0.440 |
| Cr3+,Cr2+/Pt | Cr3+ + e = Cr2+ | -0.408 |
| Cd2+/Cd | Cd2+ + 2e = Cd | -0.403 |
| Ti3+, Ti2+/Pt | Ti3+ + e = Ti2+ | -0.369 |
| Tl+/Tl | Tl+ + e = Tl | -0.3363 |
| Co2+/Co | Co2+ + 2e = Co | -0.277 |
| Ni2+/Ni | Ni2+ + 2e = Ni | -0.250 |
| Mo3+/Mo | Mo3+ + 3e = Mo | -0.20 |
| Sn2+/Sn | Sn2+ + 2e = Sn | -0.136 |
| Pb2+/Pb | Pb2+ + 2e = Pb | -0.126 |
| Ti4+, Ti3+/Pt | Ti4+ +e = Ti3+ | -0.04 |
| D+/D2, Pt | D+ + e = 1/2 D2 | -0.0034 |
| H+/H2, Pt | H+ + e = 1/2 H2 | 0.000 |
| Ge2+/Ge | Ge2+ + 2e = Ge | +0.01 |
| Br-/AgBr/Ag | AgBr + e = Ag + Br- | +0.0732 |
| Sn4+, Sn2+/Pt | Sn4+ + 2e = Sn2+ | +0.15 |
| Cu2+, Cu+/Pt | Cu2+ + e = Cu+ | +0.153 |
| Cu2+/Cu | Cu2+ + 2e = Cu | +0.337 |
| Fe(CN)64-, Fe(CN)63-/Pt | Fe(CN)63- + e = Fe(CN)64- | +0.36 |
| OH-/O2, Pt | l/2 O2 + H2O + 2e = 2OH- | +0.401 |
| Cu+/Cu | Cu+ + e = Cu | +0.521 |
| J-/J2, Pt | J2 + 2e = 2J- | +0.5355 |
| Te4+/Te | Te4+ + 4e = Te | +0.56 |
| MnO4-, MnO42-/Pt | MnO4- + e = MnO42- | +0.564 |
| Rh2+/Rh | Rh2+/Rh | +0.60 |
| Fe3+, Fe2+/Pt | Fe3+ + e = Fe2+ | +0.771 |
| Hg22+/Hg | Hg22+ + 2e = 2Hg | +0.788 |
| Ag+/Ag | Ag+ + e = Ag | +0.7991 |
| Hg2+/Hg | Hg2+ + 2e = Hg | +0.854 |
| Hg2+, Hg+/Pt | Hg2+ + e = Hg+ | +0.91 |
| Pd2+/Pd | Pd2+ + 2e = Pd | +0.987 |
| Br-/Br2, Pt | Br2 + 2e = 2Br- | +1.0652 |
| Pt2+/Pt | Pt2+ + 2e = Pt | +1.2 |
| Mn2+, H+/MnO2, Pt | MnO2 + 4H+ + 2e = Mn2+ + 2H2O | +1.23 |
| Cr3+, Cr2O72-, H+/Pt | Cr2O72- + 14H+ + 6e = 2Cr3+ + 7H2O | +1.33 |
| Tl3+, Tl+/Pt | Tl3+ + 2e = Tl+ | +1.25 |
| Cl-/Cl2, Pt | Cl2 + 2e = 2Cl- | +1.3595 |
| Pb2+, H+/PbO2, Pt | PbO2 + 4H+ + 2e = Pb2+ + 2H2O | +1.455 |
| Au3+/Au | Au3+ + 3e = Au | +1.498 |
| MnO4-, H+/MnO2, Pt | MnO4- + 4H+ + 3e = MnO2 + 2H2O | +1.695 |
| Ce4+, Ce3+/Pt | Ce4+ + e = Ce3+ | +1.61 |
| SO42-,H+/PbSO4, PbO2, Pb | PbO2 + SO42- + 4H+ + 2e = PbSO4 + 2H2O | +1.682 |
| Au+/Au | Au+ + e = Au | +1.691 |
| H-/H2, Pt | H2 + 2e = 2H- | +2.2 |
| F-/F2, Pt | F2 + 2e = 2F- | +2.87 |
авим элемент, в котором медный электрод является анодом. Катодом можно выбрать любой металл, имеющий больший электродный потенциал, например, ртуть:
|
|
|
(-)Cu / Cu 2+//Hg2+/ Hg (+).
Запишем уравнение реакций:
Cu(тв.)-2e=Cu2+(водн.) – на аноде;
Hg2+(водн.) +2e=Hg(ж.) – на катоде.
Суммарное уравнение:
Cu(тв.)+ Hg2+(водн.) =Cu2+(водн.) + Hg(ж.). 
Так как активность ионов металла в растворах равна 1 моль/кг воды, то в данном элементе оба значения потенциалов – стандартные:
.
Ответ: ε=0,51 В.
40. ЭДС Zn-Mg гальванического элемента (условия стандартные) равна
41. ЭДС Al-Cd гальванического элемента (условия стандартные) равна
42. ЭДС Ag-Pb гальванического элемента (условия стандартные) равна
43. ЭДС Sn-Cu гальванического элемента (условия стандартные) равна
44. ЭДС Pt-Cr гальванического элемента (условия стандартные) равна
45. ЭДС Fe-Bi гальванического элемента (условия стандартные) равна
В гальваническом элементе анодом становится металл, обладающий меньшим значением электродного потенциала восстановления, а катодом – металл с большим значением электродного потенциала восстановления.
46. Если в гальваническом элементе никель катод, то анодом будут металлы
47. Если в гальваническом элементе свинец катод, то анодом будут металлы
48. Если в гальваническом элементе цинк анод, то катодом будут металлы
49. При электролизе водного раствора MgSO4 на катоде будет выделяется MgSO4
2H2O = 2H2 + O2
kat: 2H2O + 2e = H2 + 2OH(-)
an: 2H2O = O2 + 4H(+) + 4e
|
|
|
50. При электролизе водного раствора CuSO4 на катоде будет выделяется
СuSO4 ↔ Cu2++SO42−
K(-): Cu2+ + 2e = Cu0
A(+): 2H2O — 4e = O2 + 4Н
51. При электролизе водного раствора ZnCl2 на катоде будет выделяется
ZnCl2 = Zn2+ + 2Cl-
H20 = H+ + OH-
К(-) Zn2+, H2O; Zn2+ +2e = Zn
А(+) Cl-, H20; 2Cl- 2e = Cl2;
ZnCl2 = Zn + Cl2
52. При электролизе водного раствора AgNO3 на катоде будет выделяется
Нитрат серебра диссоциирует согласно уравнению: AgNO3 = Ag+ + NO3 –. На инертных электродах протекают следующие процессы:
K(–): Ag+ + e = Ag;
А (+): 2H2O – 4e = 4H+ + O2↑
. Сокращенное ионное уравнение электролиза: 4Ag+ + 2H2O = 4Ag + 4H+ + O2↑. Молекулярное уравнение: 4AgNO3 + 2H2O = 4Ag + 4HNO3 + O2↑.
53. При пропускании 9660 Кл электричества через расплав MgCl2 на катоде выделяется
54. При электролизе водного раствора CuCl2 на катоде выделяется 3,2 г меди, а на аноде
55. При электролизе расплава KI на катоде и на аноде выделяется 
56. При электролизе водного раствора NaCl на катоде выделяется
NaCl  Na+ + Cl–,
Na+ + Cl–,
H2O  Н+ + ОН–;
Н+ + ОН–;
катод (–) (Na+; Н+): H+ + е = H0, 2H0 = H2
(2H2O + 2 е = H2 + 2OH–),
анод (+) (Cl–; OН–): Cl– – е = Cl0, 2Cl0 = Cl2;
2NaCl + 2H2O = 2NaOH + Cl2  + H2
+ H2  .
.
57. При электролизе расплава солей натрия, калия, алюминия и магния катионы будут восстанавливаться в следующем порядке
58. При электролизе раствора, содержащего ионы Cu2+, Ni2+, Fe2+, Pb2+ восстановление будет протекать в следующем порядке
59. При электролизе раствора Zn(NO3)2 на аноде (инертном) выделяется

б) Zn(NO3)2 = Zn2+ + 2NO3-
K(-): Zn2+ + 2e = Zn
2H2O + 2e = H2 + 2OH
A(+): 2H2O - 4e = O2 + 4H+
Общее ур-е
Zn(NO3)2 + 2H2O = H2 + O2 + Zn(OH)2
60. При пропускании 9660 Кл электричества через расплав Pb(NO3)2 на катоде выделяется
61. При электролизе водного раствора CaCl2 на катоде выделяется
катод 2H2O + 2e- = H2 + 2OH-
анод 2Cl- - 2e- = Cl2
CaCl2 + 2H2O = H2 + Cl2 + Ca(OH)2
62. При электролизе водного раствора NaCl на катоде выделяется 1,12 л H2, а на аноде
63. При пропускании 96500 Кл электричества через раствор MgSO4 на электродах выделяется
64. При пропускании 96500 Кл электричества через раствор CuCl2 на электродах выделяется
65. Сумма коэффициентов в уравнении реакции взаимодействия серебра с разбавленной азотной кислотой равна
4HNO3(разб) + 3Ag = 3AgNO3 + NO + 2H2O
66. Сумма коэффициентов в уравнении реакции взаимодействия свинца с разбавленной азотной кислотой равна
3Pb+8HNO3=3Pb(NO3)2+2NO+4H2O
67. Сумма коэффициентов в уравнении реакции взаимодействия олова с гидроксидом калия равна
Sn0 + 2 KOHI → K2SnIIO2 + H20
68. Сумма коэффициентов в уравнении реакции взаимодействия бериллия с гидроксидом калия равна
Be + KOH = K2BeO2 + H2O
69. Сумма коэффициентов в уравнении реакции взаимодействия магния с разбавленной азотной кислотой, зная, что одним из продуктов является NH3, равна
4Mg + 10HNO3 = NH4NO3 + 4Mg(NO3)2 + 3H2O
|
|
|
восстановитель Mg(0) - 2e = Mg(+2) 8 4 окисление
окислитель N(+5) + 8e = N(-3) 2 1 восстановление
70. Наибольшая скорость коррозии будет наблюдаться между парой металлов
71. Наибольшая скорость коррозии будет наблюдаться между парой металлов
72. Из предложенных металлов анодным покрытием для марганца будет
73. Из предложенных металлов катодным покрытием для свинца будет
74. В сильно кислой и сильно щелочной среде будет корродировать металл
75. В сильно кислой и сильно щелочной среде будет корродировать металл
76. При электрокоррозии свинцовых труб в кислой почве протекают процессы
|
|
|


