 |
Ковалентная связь. Кристаллическая структура кремния
|
|
|
|
Ковалентная связь
Металлическая связь, как вы помните, обеспечивается газом свободных электронов, который, подобно клею, удерживает положительные ионы в узлах кристаллической решётки. Полупроводники устроены иначе — их атомы скрепляет ковалентная связь. Давайте вспомним, что это такое.
Электроны, находящиеся на внешнем электронном уровне и называемые валентными, слабее связаны с атомом, чем остальные электроны, которые расположены ближе к ядру. В процессе образования ковалентной связи два атома вносят «в общее дело» по одному своему валентному электрону. Эти два электрона обобществляются, то есть теперь принадлежат уже обоим атомам, и потому называются общей электронной парой (рис. 2).
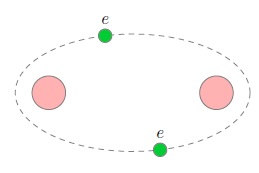
Рис. 2. Ковалентная связь
Обобществлённая пара электронов как раз и удерживает атомы друг около друга (с помощью сил электрического притяжения). Ковалентная связь — это связь, существующая между атомами за счёт общих электронных пар. По этой причине ковалентная связь называется также парноэлектронной.
Кристаллическая структура кремния
Теперь мы готовы подробнее изучить внутреннее устройство полупроводников. В качестве примера рассмотрим самый распространённый в природе полупроводник — кремний. Аналогичное строение имеет и второй по важности полупроводник — германий.
Пространственная структура кремния представлена на рис. 3 (автор картинки — Ben Mills). Шариками изображены атомы кремния, а трубки, их соединяющие, — это каналы ковалентной связи между атомами.
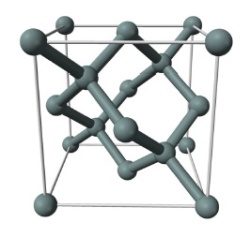 Рис. 3. Кристаллическая структура кремния
Рис. 3. Кристаллическая структура кремния
Обратите внимание, что каждый атом кремния скреплён с четырьмя соседними атомами. Почему так получается?
|
|
|
Дело в том, что кремний четырёхвалентен — на внешней электронной оболочке атома кремния расположены четыре валентных электрона. Каждый из этих четырёх электронов готов образовать общую электронную пару с валентным электроном другого атома. Так и происходит! В результате атом кремния окружается четырьмя пристыковавшимися к нему атомами, каждый из которых вносит по одному валентному электрону. Соответственно, вокруг каждого атома оказывается по восемь электронов (четыре своих и четыре чужих).
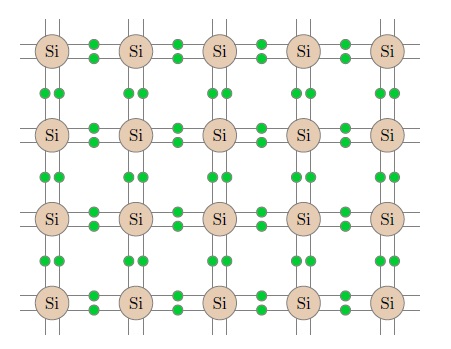 Более подробно мы видим это на плоской схеме кристаллической решётки кремния (рис. 4).
Более подробно мы видим это на плоской схеме кристаллической решётки кремния (рис. 4).
Рис. 4. Кристаллическая решётка кремния
Ковалентные связи изображены парами линий, соединяющих атомы; на этих линиях находятся общие электронные пары. Каждый валентный электрон, расположенный на такой линии, большую часть времени проводит в пространстве между двумя соседними атомами.
Однако валентные электроны отнюдь не «привязаны намертво» к соответствующим парам атомов. Происходит перекрытие электронных оболочек всех соседних атомов, так что любой валентный электрон есть общее достояние всех атомов-соседей. От некоторого атома 1 такой электрон может перейти к соседнему с ним атому 2, затем — к соседнему с ним атому 3 и так далее. Валентные электроны могут перемещаться по всему пространству кристалла — они, как говорят, принадлежат всему кристаллу (а не какой-либо одной атомной паре).
Тем не менее, валентные электроны кремния не являются свободными (как это имеет место в металле). В полупроводнике связь валентных электронов с атомами гораздо прочнее, чем в металле; ковалентные связи кремния не разрываются при невысоких температурах. Энергии электронов оказывается недостаточно для того, чтобы под действием внешнего электрического поля начать упорядоченное движение от меньшего потенциала к большему. Поэтому при достаточно низких температурах полупроводники близки к диэлектрикам — они не проводят электрический ток.
|
|
|


