 |
Механизм необратимого ингибирования ацетилхолинэстеразы
|
|
|
|
Билет
№29 1Биоэнергетика. Биологические виды энергии. Тканевое дыхание и биологическое окисление.С позиций термодинамики (см. главу 4) метаболизм представляет собой совокупность процессов, в которой реакции, потребляющие энергию из внешней среды (эндэргонические), сопрягаются с энергодающими (экзэрго-ническими) реакциями, что позволяет живым существам оказывать постоянное сопротивление нарастанию энтропии. Выяснение биохимических механизмов, приводящих к генерации различных форм биологической энергии, является предметом биоэнергетики. Источником энергии служат реакции, в ходе которых соединения, содержащие атомы углерода в высо-ковосстановленном состоянии, подвергаются окислению, а специальные дыхательные переносчики присоединяют протоны и электроны (восстанавливаются) и в таком виде транспортируют атомы водорода к дыхательной цепи. Биологические виды энергии. Энергетические превращения в живой клетке подразделяют на две группы: локализованные в мембранах и протекающие вцитоплазме. В каждом случае для «оплаты» энергетических затрат используется своя «валюта»: в мембране это ΔμН+ или ΔμNa+, а в цитоплазме – АТФ,креатинфосфат и другие макроэргические соединения. Непосредственным источником АТФ являются процессы субстратного и окислительного фосфорилирования. Процессы субстратного фосфорилирования наблюдаются при гликолизе и на одной из стадий цикла трикарбоновых кислот (реакциясукцинил-КоА —> сукцинат; см. главу 10). Генерация ΔμН+ и ΔμNa, используемых для окислительного фосфорилирования, осуществляется в процессе транспорта электронов в дыхательной цепиэнергосопря-гающихмембран. Энергия разности потенциалов на сопрягающих мембранах может обратимо превращаться в энергию АТФ. Эти процессы катализируются Н+-АТФ-синтазой вмембранах, генерирующих протонный потенциал, или Na+-АТФ-синтазой (Na+-АТФазой) в «натриевых мембранах» алкалофиль-ных бактерий, поддерживающих ΔμNa+ [Скулачев В.П., 1989]. На рис. 9.6 представлена схема энергетики живых клеток, использующих ΔμН+ в качестве мембранной формы конвертируемой энергии. На схеме видно, что свет или энергия субстратов дыхания утилизируется ферментами фотосинтетической или дыхательной редокс-цепи (у галобактерий – бактериородопси-ном). Генерируемый потенциал используется для совершения полезной работы, в частности для образования АТФ. Будучи макроэргическим соединением, АТФ выполнняет функцию аккумулирования биологической энергии и ее последующего использования для выполнения клеточных функций. «Макроэргичность» АТФ объясняется рядом особенностей его молекулы. Это прежде всего высокая плотность зарядов, сконцентрированная в «хвосте» молекулы, обеспечивающая легкость диссоциации терминального фосфата при водном гидролизе. Продукты этого гидролизапредставляют собой АДФ и неорганический фосфат и далее – АМФ и неорганический фосфат. Это обеспечивает высокую величину свободной энергиигидролиза терминального фосфата АТФ в водной среде.Красной стрелкой показана взаимозаменяемость в клетке двух клеточных видов энергии - АТФ и ΔμН+, для которых имеются также специальные буферные системы: креатинфосфат для АТФ (клетки животных) и градиент ионов Na (алкалофильные бактерии). Тканевоедыханиеи биологическоеокисление. Распад органических соединений в живых тканях, сопровождающийся потреблением молекулярногокислорода и приводящий к выделению углекислого газа и воды и образованию биологических видов энергии, называется тканевымдыханием. Тканевоедыхание представляют как конечный этап пути превращений моносахаров (в основном глюкозы) до указанных конечных продуктов, в который на разных стадиях включаются другие сахара и их производные, а также промежуточные продукты распада липидов (жирные кислоты), белков (аминокислоты) и нуклеиновыхоснований. Итоговая реакция тканевого дыхания будет выглядеть следующим образом:С6Н12О6 + 6O2 = 6СO2+ 6Н2O + 2780 кДж/моль 2Гормоны надпочечников. Гормоны мозгового вещества надпочечников. Их влияние на обмен углеводов Они относятся к группе фенилалкиламинов и являются катехоламинами (пирокатехоламинами). Известны три вещества этой группы: адреналин (80%), норадреналин (20%), дофамин (менее1%). Они образуются при последовательных реакциях из аминокислоты тирозина.Собственно гормоном можно назвать только адреналин, поскольку два других катехоламина играют в основном медиаторную роль: норадреналин – в симпатической нервной системе, дофамин – в центральной. Адреналин относят к медиаторам симпатической и центральной нервной системы, а также к стресс-гормонам.
|
|
|
|
|
|
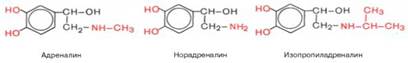 В плазме крови оба гормона присутствуют как в свободном, так и в связанном, в частности, с альбуминами состоянии. Небольшие количества обоих гормонов откладываются в виде соли с АТФ в нервных окончаниях, освобождаясь в ответ на их раздражение. Адреналин инорадреналин, как идофамин (см. структуру), относятся к катехоламинам, т.е. к классу органических веществ, оказывающих сильное биологическое действие. Кроме того, все они оказывают мощное сосудосуживающее действие, вызывая повышение артериального давления, и в этом отношении действие их сходно с действием симпатической нервной системы. Известно мощное регулирующее влияние этих гормонов на обмен углеводов в организме. Так, в частности,адреналин вызывает резкое повышение уровня глюкозы в крови, что обусловлено ускорением распада гликогена в печени под действием фермента фосфори-лазы (см. главу 10). Адреналин, как и глюкагон, активирует фосфорилазу не прямо, а через систему аденилатциклаза-цАМФ-протеинкиназа (см. далее). Гипергликемическйй эффект норадреналина значительно ниже – примерно 5% от действия адреналина. Параллельно отмечаются накоплениегексозофосфатов в тканях, в частности в мышцах, уменьшение концентрации неорганического фосфата и повышение уровня ненасыщенных жирных кислот вплазме крови. Имеются данные о торможении окисления глюкозы в тканях под влиянием адреналина. Это действие некоторые авторы связывают с уменьшением скорости проникновения (транспорта) глюкозы внутрь клетки. Механизм действия катехоламинов, включающий α- и β-адренергическиерецепторы, аденилатциклазную систему и другие факторы, рассмотрен в конце данной главы.
В плазме крови оба гормона присутствуют как в свободном, так и в связанном, в частности, с альбуминами состоянии. Небольшие количества обоих гормонов откладываются в виде соли с АТФ в нервных окончаниях, освобождаясь в ответ на их раздражение. Адреналин инорадреналин, как идофамин (см. структуру), относятся к катехоламинам, т.е. к классу органических веществ, оказывающих сильное биологическое действие. Кроме того, все они оказывают мощное сосудосуживающее действие, вызывая повышение артериального давления, и в этом отношении действие их сходно с действием симпатической нервной системы. Известно мощное регулирующее влияние этих гормонов на обмен углеводов в организме. Так, в частности,адреналин вызывает резкое повышение уровня глюкозы в крови, что обусловлено ускорением распада гликогена в печени под действием фермента фосфори-лазы (см. главу 10). Адреналин, как и глюкагон, активирует фосфорилазу не прямо, а через систему аденилатциклаза-цАМФ-протеинкиназа (см. далее). Гипергликемическйй эффект норадреналина значительно ниже – примерно 5% от действия адреналина. Параллельно отмечаются накоплениегексозофосфатов в тканях, в частности в мышцах, уменьшение концентрации неорганического фосфата и повышение уровня ненасыщенных жирных кислот вплазме крови. Имеются данные о торможении окисления глюкозы в тканях под влиянием адреналина. Это действие некоторые авторы связывают с уменьшением скорости проникновения (транспорта) глюкозы внутрь клетки. Механизм действия катехоламинов, включающий α- и β-адренергическиерецепторы, аденилатциклазную систему и другие факторы, рассмотрен в конце данной главы.
|
|
|
Билет№28 1Ингибиторы ферментов: обратимые и необратимые.В медицине активно разрабатываются и используются соединения, изменяющие активность ферментов с целью регуляции скорости метаболических реакций и уменьшения синтеза определенных веществ в организме.Подавление активности ферментов обычно называют ингибированием, однако это не всегда корректно. Ингибитором называется вещество, вызывающее специфичное снижение активности фермента. Таким образом, неорганические кислоты и тяжелые металлы ингибиторами не являются, а являются инактиваторами, так как снижают активность любых ферментов, т.е. действуют неспецифично. Ингибирование ферментов Можно выделить два основных направления ингибирования по прочности связывания фермента с ингибитором ингибирование бывает обратимым и необратимым. по отношению ингибитора к активному центру фермента ингибирование делят на конкурентное и неконкурентное. Необратимое ингибирование При необратимом ингибировании происходит связывание или разрушение функциональных групп фермента, необходимых для проявления его активности.

Механизм необратимого ингибирования ацетилхолинэстеразы
Обратимое ингибированиеПри обратимом ингибировании происходит непрочное связывание ингибитора с функциональными группами фермента, вследствие чего активность фермента постепенно восстанавливается.Примером обратимого ингибитора может служить прозерин, связывающийся с ферментом ацетилхолинэстеразой в ее активном центре. Группа ингибиторов холинэстеразы (прозерин, дистигмин, галантамин) используется при миастении, после энцефалита, менингита, травм ЦНС.2гликолиз.последовательность ферментативных реакций(схема). ГЛИКОЛИЗ (от греч. glykys-сладкий и lysis - разложение, растворение, распад), анаэробное (без участия О2) негидролитич. расщепление углеводов (гл. обр. глюкозы) в цитоплазме под действием ферментов, сопровождающееся синтезом АТФ и заканчивающееся образованием молочной к-ты (см. рис.). Гликолиз одной молекулы глюкозы м. б. выражен след. ур-нием:
|
|
|
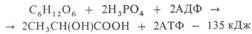
где АДФ-аденозиндифосфат. Субстратами гликолиза кроме глюкозы м. б. другие моносахариды, а также полисахариды. В мышечной ткани, где основной субстрат гликолиза-гликоген, процесс начинается с р-ции I и наз. гликогенолизом. У растений субстратом для гликолиза может служить крахмал. Первые этапы гликолиза, спиртового и нек-рых. др. видов брожениясходны.Стадии, в к-рых осуществляются необратимые р-ции (II-IV), играют существ. роль в регуляции скорости гликолиза. Наиб. важный регуляторный фермент-фосфофруктокиназа, катализирующая р-цию III; ее активность ингибируется АТФ, НАДН, лимонной и жирными к-тами, стимулируется АДФ и АМФ. Р-ции II и IV катализируются соотв. гексокиназой ипируваткиназой, активность к-рых регулируется адениловыми нуклеотидами, промежуточными продуктами гликолиза и цикла трикарбоновых к-т. У животных и человека в регуляции гликолиза принимают участие также гормоны.

Схема гликолиза. В одинарных рамках-субстраты гликолиза, АТФ -аденозинтрифосфат, АДФ-аденозиндифосфат, НАДН и НАД-соотв. восстановленная и окисленная формы никотинамидадениндинуклеотида, Р-остаток фосфорной к-ты, ~ -высокоэргич. связь.В условиях недостаточности кислорода гликолиз-единств. процесс, поставляющий энергию для осуществления физиол. ф-ций организма. В аэробных условиях гликолиз-первая стадия окислит. превращения углеводов: в присут. О2 пировиноградная к-та может подвергаться дальше окислит. декарбоксилированию, а образующаяся уксусная к-та в виде СН3С(О)КоА (КоА-остаток кофермента А) полностью окисляться до СО2 и воды в цикле трикарбоновых к-т.Интенсивный гликолиз происходит в скелетных мышцах, где он поставляет энергию для мышечных сокращений, а также в печени, сердце, мозге животных и человека. В клеткахосуществляется тонкая регуляция окислит. и анаэробного обмена. Подавление гликолиза дыханием в присут. О2 (эффект П а с т е р а) обеспечивает клетке Наиб. экономный механизм образования богатых энергией соединений. В тканях, где такой эффект отсутствует (напр., в эмбриональных и опухолевых), гликолиз протекает очень активно. В нек-рых тканях с интенсивным гликолизом наблюдается подавление тканевого дыхания (эффект Крабтри).Гликолиз-простейшая форма биол. механизма аккумулирования энергии углеводов в АТФ. Считают, что он возник в период, когда в атмосфере Земли не было О2. При энергетически более выгодном аэробном окислении из одной молекулы глюкозы образуется 38 молекул АТФ.
|
|
|
Билет№27 1.термолабильность и специфичность ферментов. Термолабильностьферментов. Скорость химических реакций зависит от температуры, поэтому катализируемые ферментами реакции также чувствительны к изменениям температуры. Установлено, что скорость большинства биохимических реакций повышается в 2 раза при повышении температуры на 10°С и, наоборот, снижается в 2 раза при понижении температуры на 10°С. Этот показатель получил название температурного коэффициента. Однако вследствие белковой природы фермента тепловая денатурация при повышении температуры будет снижать эффективную концентрацию фермента с соответствующим снижением скорости реакции. Таким образом, термолабильность, или чувствительность к повышению температуры, является одним из характерных свойств ферментов, резко отличающих их от неорганических катализаторов. Специфичность ферментов. Ферменты обладают высокой специфичностью действия. Это свойство часто существенно отличает их от неорганическихкатализаторовВысокая специфичность ферментов обусловлена, как было отмечено, конфор-мационной и электростатическойкомплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живыхклетках.В зависимости от механизма действия различают ферменты с относительной (или групповой) и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например, пепсин в одинаковой степени расщепляетбелки животного и растительного происхождения, несмотря на то что эти белки существенно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы, ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина является пептидная —СО—NH-связь. Для действия липазы, катализирующей гидролиз жиров на глицерин и жирные кислоты, подобным местом является сложноэфирная связь. Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственного субстрата. Любые изменения (модификации) в структуре субстрата делают его недоступным для действия ферментаТаким образом, благодаря высокой специфичности действия ферменты обеспечивают протекание с большой скоростью лишь определенных химических реакций из огромного разнообразия возможных превращений в микропространстве клеток и целостном организме, регулируя тем самым интенсивность обмена веществ.2.Анаэробный путь распада глюкозы(схем).биологическое значение этого процесса.В анаэробном процессе пировиноградная кислота восстанавливается до молочной кислоты (лактата), поэтому в микробиологии анаэробный гликолиз называют молочнокислым брожением. Лактат является метаболическим тупиком и далее ни во что не превращается, единственная возможность утилизовать лактат – это окислить его обратно в пируват.Многие клетки организма способны к анаэробному окислению глюкозы. Для эритроцитов он является единственным источником энергии. Клетки скелетной мускулатуры за счет бескислородного расщепления глюкозы способны выполнять мощную, быструю, интенсивную работу, как, например, бег на короткие дистанции, напряжение в силовых видах спорта. Бескислородное окисление глюкозы усиливается при гипоксии клеток при анемиях, нарушении кровообращения в тканях.
Первый этап гликолиза 
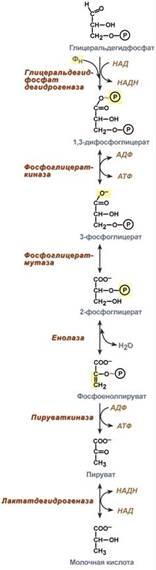
Первый этап гликолиза – подготовительный, здесь происходит затрата энергии АТФ, активация глюкозы и образование из нее триозофосфатов. Второй этап гликолизаВторой этап гликолиза – это о свобождение энергии, содержащейся в глицеральдегидфосфате, и запасание ее в форме АТФ.
Билет№26 1ФАД-зависимые дегидрогеназы: сукцинатдегидрогензы. ФАД-зависимые дегидрогеназы Данный комплекс как таковой не существует, его выделение условно. Он включает в себя ФАД-зависимые ферменты, расположенные на внутренней мембране – например, ацил-SКоА-дегидрогеназа (окисление жирных кислот), сукцинатдегидрогеназа (цикл трикарбоновых кислот), митохондриальная глицерол-3-фосфат-дегидрогеназа (челночный механизм переноса НАДН в митохондрию). Функция Восстановление ФАД в окислительно-восстановительных реакциях.Обеспечение передачи электронов от ФАДН2 на железосерные белки внутренней мембраны митохондрий. СУКЦИНАТДЕГИДРОГЕНАЗА фермент класса оксидоредуктаз, катализирующийокисление дианиона янтарной к-ты (сукцината) до дианиона фума-ровой к-ты (фумарата) в трикарбоновых кислот цикле; прир. акцепторы электронов в этой р-ции-убихиноны, нафтохиноны, неприродные-гексацианоферрат и нек-рые др.Сукцинатдегидрогеназа высших организмов катализирует и обратную р-цию (фумаратредуктазную)-восстановление фумарата до сукцината; донорыэлектронов -убихинолы, флавинмононуклео-тид (см. Рибофлавин) и др. У ряда микроорганизмов фумаратредуктазная р-ция катализируется спец. ферментом(фумаратредуктазой), очень близким по структуре к сукцинатдегидрогеназе. У нек-рых организмов в клетках одновременно присутствуют сукцинатдегидрогеназа и фумаратредуктаза. Сукцинатдегидрогеназа высших организмов кроме сукцината способна катализировать окисление (со значительно меньшими скоростями) его галогензамещенных и дианиона яблочной к-ты.Сукцинатдегидрогеназы всех изученных организмов прочно связаны с внутр. мембраной митохондрий (высшие животные, дрожжи) или плазматич. мембраной(бактерии и синезеленые водоросли), являясь компонентами электронотранспортной дыхат. цепи (см. Дыхание, Окислительное фосфорилиро-вание).Активность сукцинатдегидрогеназы часто используют для идентификации внутр. мембран митохондрий при фракционировании клеток и клеточных органелл 2гликогеновые болезни, причины их возникновения.Гликогеновые болезни – это наследственные заболевания, обусловленные недостаточностью каких-либо ферментов, отвечающих за метаболизм гликогена. Могут быть нарушены обе стороны обмена: как синтез гликогена, так и его распад. Средняя частота встречаемости составляет 1:40000. Гликогенозы В настоящее время гликогенозы делят по патогенетическому признаку на печеночные, мышечные и смешанные формы. Следует отметить, что при гликогенозах количество гликогена не всегда изменено, изменения могут быть только в структуре его молекулы. Печеночные гликогенозы Самый частый гликогеноз I типа или болезнь фон Гирке обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз.. Так как фермент необходим для дефосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия. Мышечные гликогенозы Для этой группы гликогенозов характерны изменения ферментов мышечной ткани. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, к болям в мышцах, судорогам. Смешанные гликогенозы Эти заболевания касаются и печени, и мышц, и других органов. Гликогеноз II типа (болезнь Помпе) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной α-1,4-глюкозидазы, поэтому данная болезнь относится к лизосомным болезням накопления. Происходит накопление гликогена в лизосомах и в цитоплазме. Заболевание составляет почти 10% всех гликогенозов и является наиболее злокачественным. Больные умирают в грудном возрасте из-за кардиомегалии и тяжелой сердечной недостаточности. Агликогенозы Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы. Симптомами является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результате гипогликемии наблюдается задержка психомоторного развития, умственная отсталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
Билет№25 1Строение и биохимические функции никотинамидных коферментов Никотинамидные коферменты - переносчики водорода в обратимых окислительно-восстановительных реакциях (гл. Никотинамидные коферменты могут вступать в обратимые окислительно-восстановительные реакции со специфичными субстратами в присутствии соответствующих дегидрогеназ. [ 1 ]Никотинамидные коферменты - никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотидфосфат (НАДФ) (схема 11.19, а) служат промежуточными акцепторами и переносчиками электронов и атомов водорода. Восстановленные формы НАД (НАДН) и НАДФ (НАДФН) выступают в роли доноров электронов и протона. Считается, что НАД и НАДФ имеют разные функции. НАД участвует в ката-болических процессах как окислитель, а восстановленная форма НАДФ (НАДФН) - в анаболических процессах в качестве восстановителя. [ 2 ]Никотинамидные коферменты обычно можно отделить от соответствующих апоферментов без существенных осложнений, однако флавиновые коферменты (11) гораздо более прочно связаны со своими апофер мента ми и часто могут быть удалены лишь после существенной денатурации. [ 3 ]Никотинамидные коферменты осуществляют свои каталитические функции переноса водорода как в окисленной, так и в восстановленной формах. [ 4 ]Никотинамидные коферменты принимают участие в отдельных реакциях углеводного, липидного и аминокислотного обмена в процессах фотосинтеза в растениях. Дегидрогеназы катализируют отдельные этапы реакций анаэробного расщепления моносахаридов с высвобождением свободной энергии и накоплением ее в аденозин-5 - трифосфате (АТФ), который является основным аккумулятором и затем генератором энергии в живой клетке. В этой метаболической реакции происходит образование макроэр-гической связи с превращением АДФ в АТФ, которые являются ключевыми энергетическими переносчиками. [ 5 ]Акцепторами атомов водорода могут быть различные вещества - никотинамидные коферменты (НАД и НАДФ), цитохромы, кислород, дисульфидные соединения и некоторые другие. Оксидоредуктазы являются трансферазами, ускоряющими перенос атомов водорода (электронов) от одного вещества к другому, но в отличие от других трансфераз обладают рядом особенностей. [ 6 ] 2гормоны гипофиза. Вазопрессин и окситоцин. Строение и биологические функции. Гормоны вазопрессин и окситоцин синтезируются рибосомальным путем, Далее в виде комплексов нейрофизин–гор-мон они мигрируют вдоль аксона и достигают задней доли гипофиза, где откладываются про запас; после диссоциации комплекса свободный гормон секретируется в кровь. Нейрофизины также выделены в чистом виде, и выяснена первичная структура двух из них (92 из 97 аминокислотных остатков соответственно); это богатые цистеином белки, содержащие по семь дисульфидных связей.Химическое строение обоих гормонов было расшифровано классическими работами В. дю Виньо и сотр., впервые выделивших эти гормоны из задней долигипофиза и осуществивших их химический синтез. Оба гормона представляют собой нонапептиды следующего строения: 
Вазопрессин отличается от окситоцина двумя аминокислотами: он содержит в положении 3 от N-конца фенилаланин вместо изолейцина и в положении 8 –аргинин вместо лейцина. Указанная последовательность 9 аминокислот характерна для вазопрессина человека, обезьяны, лошади, крупного рогатого скота, овцы и собаки. В молекуле вазопрессина из гипофиза свиньи вместо аргинина в положении 8 содержится лизин, отсюда название «лизин-вазопрессин». У всех позвоночных, за исключением млекопитающих, идентифицирован, кроме того, вазотоцин. Этот гормон, состоящий из кольца с S—S мостиком окситоцина и боковой цепью вазопрессина, был синтезирован химически В. дю Виньо задолго до выделения природного гормона. Высказано предположение, что эволю-ционно все нейрогипофизарные гормоны произошли от одного общего предшественника, а именно аргинин-вазотоцина, из которого путем одиночных мутацийтриплетов генов образовались модифицированные гормоны.Основной биологический эффект окситоцина у млекопитающих связан со стимуляцией сокращения гладких мышц матки при родах и мышечных волокон вокруг альвеол молочных желез, что вызывает секрецию молока. Вазопрессин стимулирует сокращение гладких мышечных волокон сосудов, оказывая сильное вазопрессорное действие, однако основная роль его в организме сводится к регуляции водного обмена, откуда его второе название антидиуретического гормона. В небольших концентрациях (0,2 нг на 1 кг массы тела) вазопрессин оказывает мощное антидиуретическое действие – стимулирует обратный токводы через мембраны почечных канальцев. В норме он контролирует осмотическое давление плазмы крови и водный баланс организма человека. При патологии, в частности атрофии задней доли гипофиза, развивается несахарный диабет – заболевание, характеризующееся выделением чрезвычайно больших количеств жидкости с мочой. При этом нарушен обратный процесс всасывания воды в канальцах почек.Относительно механизма действия нейрогипофизарных гормонов известно, что гормональные эффекты, в частности вазопрессина, реализуются
через аденилатциклазную систему (см. далее). Однако конкретный механизм действия вазопрессина на транспорт воды в почках пока остается неясным.
Билет№24 1Коферментные функции витаминов РР и В2 Витамин В2 (рибофлавин, витамин роста)Источники Достаточное количество содержат мясные продукты, печень, почки, молочные продукты, дрожжи. Также витамин образуется кишечными бактериями. Суточная потребность 2,0-2,5 мг. Строение В состав рибофлавина входит флавин – изоаллоксазиновое кольцо с заместителями (азотистое основание) и спирт рибитол. Коферментные формы витамина дополнительно содержат либо только фосфорную кислоту – флавинмононуклеотид (ФМН), либо фосфорную кислоту, дополнительно связанную с АМФ – флавинадениндинуклеотид. Метаболизм В кишечнике рибофлавин освобождается из состава пищевых ФМН и ФАД, и диффундирует в кровь. В слизистой кишечника и других тканях вновь образуется ФМН и ФАД. Биохимические функции Кофермент оксидоредуктаз – обеспечивает перенос 2 атомов водорода в окислительно-восстановительных реакциях.Никотиновая кислота представляет собой соединение пиридинового ряда, содержащее карбоксильную группу (никотинамид отличается наличием амидной группы).
 Витамин РР малорастворим в воде (примерно 1%), но хорошо растворим в водных растворах щелочей. Никотиновая кислота кристаллизуется в виде белых игл.Наиболее характерными признаками авитаминоза РР, т.е. пеллагры (от итал. pelle agra – шершавая кожа), являются поражения кожи (дерматиты), пищеварительного тракта (диарея) и нарушения нервной деятельности (деменция). Биологическая роль. Витамин РР входит в состав НАД или НАДФ, являющихся коферментами большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ (формулы ко-ферментов приведены в главе 9).Показано, что ряд дегидрогеназ использует только НАД и НАДФ (соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа), другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них (например, глутаматдегидрогеназа; см. главу 12). В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновымиферментами (молекулярные механизмы участия пиридиновых нуклеотидов в этом процессе подробно рассматриваются в главе 9). Распространение в природе и суточная потребность. Никотиновая кислота также относится к витаминам, широко распространенным в растительных и животных организмах. Для человека основными источниками никотиновой кислоты и ее амида являются рис, хлеб, картофель, мясо, печень, почки, морковь и другие продукты. Суточная потребность для взрослого человека составляет 18 мг.
Витамин РР малорастворим в воде (примерно 1%), но хорошо растворим в водных растворах щелочей. Никотиновая кислота кристаллизуется в виде белых игл.Наиболее характерными признаками авитаминоза РР, т.е. пеллагры (от итал. pelle agra – шершавая кожа), являются поражения кожи (дерматиты), пищеварительного тракта (диарея) и нарушения нервной деятельности (деменция). Биологическая роль. Витамин РР входит в состав НАД или НАДФ, являющихся коферментами большого числа обратимо действующих в окислительно-восстановительных реакциях дегидрогеназ (формулы ко-ферментов приведены в главе 9).Показано, что ряд дегидрогеназ использует только НАД и НАДФ (соответственно малатдегидрогеназа и глюкозо-6-фосфатдегидрогеназа), другие могут катализировать окислительно-восстановительные реакции в присутствии любого из них (например, глутаматдегидрогеназа; см. главу 12). В процессе биологического окисления НАД и НАДФ выполняют роль промежуточных переносчиков электронов и протонов между окисляемым субстратом и флавиновымиферментами (молекулярные механизмы участия пиридиновых нуклеотидов в этом процессе подробно рассматриваются в главе 9). Распространение в природе и суточная потребность. Никотиновая кислота также относится к витаминам, широко распространенным в растительных и животных организмах. Для человека основными источниками никотиновой кислоты и ее амида являются рис, хлеб, картофель, мясо, печень, почки, морковь и другие продукты. Суточная потребность для взрослого человека составляет 18 мг.
2нарушение углеводного обмена, сахарный диабет.При некоторых состояниях можно наблюдать повышение содержания глюкозы в крови – гипергликемию, а также понижение концентрации глюкозы – гипогликемию. Гипергликемия является довольно частым симптомом различных заболеваний, прежде всего связанных с поражением эндокринной системы. Сахарный диабет. В регуляции гликолиза и глюконеогенеза большую роль играет инсулин. При недостаточности содержания инсулина возникает заболевание, которое носит название «сахарный диабет»: повышается концентрация глюкозы в крови (гипергликемия), появляется глюкоза в моче (глюкозурия) и уменьшается содержание гликогена в печени. Мышечная ткань при этом утрачивает способность утилизировать глюкозу крови. В печени при общем снижении интенсивности биосинтетических процессов: биосинтеза белков, синтеза жирных кислот из продуктов распада глюкозы – наблюдается усиленный синтезферментов глюконеогенеза.Развитие гипергликемии при диабете можно рассматривать также как результат возбуждения метаболических центров в ЦНС импульсами с хе-морецепторовклеток, испытывающих энергетический голод в связи с недостаточным поступлением глюкозы в клетки ряда тканей. Роль системы фруктозо-2,6-бисфосфата врегуляции метаболизма углеводов, а также нарушения ее функционирования при сахарном диабете см. главу 16.Гипергликемия может возникнуть не только при заболевании поджелудочной железы, но и в результате расстройства функции других эндокринных желез, участвующих в регуляции углеводного обмена. Так, гипергликемия может наблюдаться при гипофизарных заболеваниях, опухолях коркового веществанадпочечников, гиперфункции щитовидной железы. Иногда гипергликемия появляется во время беременности. Наконец, гипергликемия возможна при органических поражениях ЦНС, расстройствах мозгового кровообращения, болезнях печени воспалительного или дегенеративного характера. Поддержание постоянства уровня глюкозы в крови, как отмечалось,– важнейшая функция печени, резервные возможности которой в этом отношении весьма велики. Поэтомугипергликемия, обусловленная нарушением функции печени, выявляется обычно при тяжелых ее поражениях. Гипогликемия. Нередко гипогликемия связана с понижением функций тех эндокринных желез, повышение функций которых приводит, как отмечалось, кгипергликемии. В частности, гипогликемию можно наблюдать при гипофизарной кахексии, аддисоновой болезни, гипотиреозе. Резкое снижение уровня глюкозыв крови отмечается при аденомах поджелудочной железы вследствие повышенной продукции инсулина β-клетками панкреатических островков. Кроме того, гипогликемия может быть вызвана голоданием, продолжительной физической работой, приемом β-ганглиоблока-торов. Низкий уровень глюкозы в крови иногда отмечается при беременности, лактации.Гипогликемия может возникнуть при введении больным сахарным диабетом больших доз инсулина. Как правило, она сопровождает почечную глюкозурию, возникающую вследствие снижения «почечного порога» для глюкозы. Глюкозурия. Обычно присутствие глюкозы в моче (глюкозурия) является результатом нарушения углеводного обмена вследствие патологических изменений в поджелудочной железе (сахарный диабет, острый панкреатит и т.д.). Реже встречается глюкозурия почечного происхождения, связанная с недостаточностью резорбции глюкозы в почечных канальцах. Как временное явление глюкозурия может возникнуть при некоторых острых инфекционных и нервных заболеваниях, после приступов эпилепсии, сотрясения мозга.
Билет№23
1основные этапы синтеза белка. Написать две реакции этапа активирования аминокислот(схема).Синтез белка представляет собой циклический энергозависимый многоступенчатый процесс, в котором свободные аминокислоты полимеризуются в генетически детерминированную последовательность с образованием полипептидов. Система белкового синтеза, точнее система трансляции, которая использует генетическую информацию, транскрибированную в мРНК, включает участие множества разнообразных молекул (низкомолекулярные вещества имакромолекулы, а также надмолекулярные структуры). В табл. 14.1 обобщены известные к настоящему времени данные о составе белоксинтезирующей системы у про- и эукариот в каждой из 5 стадий синтеза, из которых 3 стадии (инициация, элонгация и терминация) по аналогии со стадиями синтеза полимерных молекул ДНК и РНК (см. главу 13) считаются главными и основными, а 2 стадии (активация аминокислот и постсинтетический процессинг) рассматриваются в качестве дополнительных, вспомогательных стадий синтеза. Более 100 макромолекул участвует в активировании аминокислот и их переносе на рибосомы (все тРНК, аминоацил-тРНК-синтетазы), более 60 макромолекул входит в состав 70S и 80S рибосом, и около 10 макромолекул, называемых белковыми факторами, принимающих непосредственное участие в системе трансляции. Не разбирая подробно природу других важных для синтеза факторов, рассмотрим механизм индивидуальных путей синтеза белковой молекулы в искусственной синтезирующей системе. Прежде всего при помощи изотопного метода было выяснено, что синтез белка начинается с N-конца и завершается С-концом, т.е. процесс протекает в направлении NН2 –> СООН.Белковый синтез, или процесс трансляции, может быть условно разделен на 5 стадий, из которых две считаются подготовительными и завершающимися, в частности активирование аминокислот и постсинтетическая модификация белковой молекулы, и 3 стадии составляют собственно трансляцию.
R-CH(NH)2-COOH+АТФ↦R-CH(NH)2-CO∼O-АMФ+ФФн аминоацил- аденилат R-CH(NH)2-CO∼О-АМФ+тРНК↦ R-CH(NH)2-CO∼O-тРНК+АМФ аминоацил- тРНК
2переваривание и всасывание углеводов в жкт. Расщепление крахмала (и гликогена) начинается в полости рта под действием амилазы слюны.Желудочный сок не содержит ферментов, расщепляющих сложные углеводы. В желудке действие α-амилазы слюны прекращается, так как желудочное содержимое имеет резко кислую реакцию (рН 1,5–2,5). Однако в более глубоких слоях пищевого комка, куда не сразу проникает желудочный сок, действиеамилазы некоторое время продолжается и происходит расщепление полисахаридов с образованием декстринов и мальтозы. Наиболее важная фаза распадакрахмала (и гликогена) протекает в двенадцатиперстной кишке под действием α-амилазы поджелудочного сока. Здесь рН возрастает приблизительно до нейтральных значений, при этих условиях α-амилаза панкреатического сока обладает почти максимальной активностью. Этот фермент завершает превращение крахмала и гликогена в мальтозу, начатое амилазой слюны. Напомним, что в молекулах амило-пектина и гликогена в точках ветвления существуют также α(1–>6)-глико-зидные связи. Эти связи в кишечнике гидролизуются особыми ферментами: амило-1,6-глюкозидазой и олиго-1,6-глюкозидазой (терминальная декстри-наза).Таким образом, расщепление крахмала и гликогена до мальтозы происходит в кишечнике под действием трех ферментов: панкреатической α-ами-лазы, амило-1,6-глюкозидазы и олиго-1,6-глюкозидазы.Образующаяся мальтоза оказывается только временным продуктом, так как она быстро гидролизуется под влиянием фермента мальтазы (α-глюкозидазы) на 2молекулы глюкозы. Кишечный сок содержит также активную сахаразу, под влиянием которой из сахарозы образуются глюкоза и фруктоза.Лактоза, которая содержится только в молоке, под действием лактазы кишечного сока расщепляется на глюкозу и галактозу. В конце концов углеводы пищи распадаются на составляющие их моносахариды (преимущественно глюкоза, фруктоза и галактоза), которые всасываются кишечной стенкой и затем попадают в кровь.случаем, когда дисахариды появляются в моче. Скорость всасывания отдельных моносахаридов различна. Глюкоза и галактоза всасываются быстрее, чем другие моносахариды. Принято считать, что всасывание маннозы, ксилозы и арабинозы осуществляется преимущественно путем диффузии, всасывание же большинства других моносахаридов происходит за счет активного транспорта.Щеточная каемка энтероцитов содержит системы перенос
|
|
|


