 |
Химическое выщелачивание урана из руд
|
|
|
|
1 Физико–химические основы процесса
Выщелачивание – это гетерогенный процесс.
Выщелачивание осуществляется перемешиванием (агитацией) мелкого твёрдого материала с жидким растворителем в контакте с газообразным реагентом, например, воздухом при атмосферном давлении или при повышенном давлении и температуре.
Твердое вещество, находясь в контакте с жидкостью покрывается пленкой, при этом массообмен в ней осуществляется за счет молекулярной диффузии. Молекулярная диффузия осуществляется без видимого перемещения участков фазы и обусловлена тепловым движением молекул. Она обусловлена переносом молекул вещества из области с большей его концентрацией в область с меньшей концентрацией и протекает в неподвижной среде или ламинарных пограничных слоях. Перенос вещества при молекулярной диффузии определяется законом Фика, который формулируется следующим образом: плотность потока j диффундирующих частиц пропорциональна градиенту их концентрации С
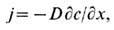
Пленка, образующаяся при контакте твердого вещества и жидкости, называется диффузионным слоем Нернста. Диффузионный слой Нернста – это слой неподвижной жидкости, транспорт вещества через который происходит в результате диффузии реагирующих частиц. За пределами этого слоя движение жидкости приводит к выравниванию концентраций во всей остальной толще раствора. Толщина этого слоя зависит от многих факторов: свойств растворителя и растворенного вещества, скорости перемешивания и т.д. В случае жидкости его толщина составляет δ = 0,02-0,05 мм.
5 основных стадий гетерогенного процесса (рисунок 1):
· Диффузия реагента из объема раствора через внешний диффузионный слой к контурной поверхности зерна;
|
|
|
· Диффузия реагента через слой твердого продукта реакции или внутри пор твердой фазы (внутренний диффузионный слой);
· Химическая реакция на поверхности выщелачиваемого материала;
· Диффузия продуктов реакции через слой твердого вещества или внутрь пор к контурной поверхности зерна;
· Диффузия продуктов реакции через внешний диффузионный слой в объем раствора.
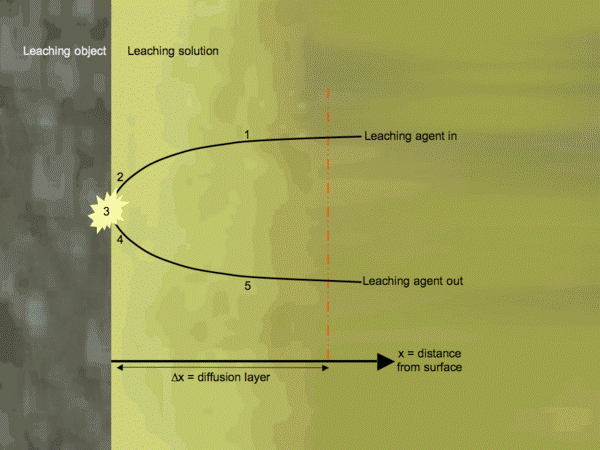 Рисунок 1
Рисунок 1
Движущая сила процесса выщелачивания.
Движущая сила процесса выщелачивания – это разность концентраций выщелачивающего вещества в объеме раствора и в слое, непосредственно примыкающем к частицам руды.
Скорость выщелачивания.
Скорость выщелачивания зависит от удельной поверхности раздела твёрдое — жидкость (то есть от размера частиц твёрдого), разности концентраций растворителя и химических реагентов на поверхности твёрдого и в объёме, вязкости растворителя, величины коэффициента диффузии, интенсивности перемешивания (уменьшение диффузионного слоя, ускорение растворения газообразных реагентов), температуры (увеличение констант скорости реакции и диффузии), парциального давления газообразного реагента (кислорода, сернистого ангидрида и др.) над раствором, концентрации растворимого окислителя, например, сульфата железа. Чаще всего выщелачивание как гетерогенный процесс протекает в диффузионной области, хотя возможны смешанные диффузионно-кинетические или кинетические режимы.
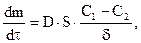
| где | 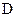
| – | коэффициент диффузии, (10-5-10-6); |

| – | суммарная поверхность твердых частиц; | |
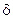
| – | толщина диффузионного слоя; | |

| – | разность концентраций выщелачивающего реагента на наружной и внутренней поверхности диффузионного слоя. |
2 Факторы, влияющие на скорость выщелачивания
1) Концентрация реагентов
Чем больше концентрация С1 тем выше скорость выщелачивания.
|
|
|
По мере протекания процесса реагент расходуется и его концентрация уменьшается. Это приводит к снижению скорости выщелачивания. Возможен гидролиз урановых растворов. Для предотвращения этого необходимо иметь избыток выщелачивающего реагента (при карбонатном выщелачивании рН =10-11, при кислотном рН = 1-1,5).
2) Толщина диффузионного слоя δ
3) Температура и давление
При увеличении температуры скорость выщелачивания возрастает.
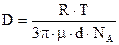
4) Скорость перемешивания (скорость агитации)
Чем выше скорость перемешивания, ем выше скорость выщелачивания
5) Размер частиц (степень измельчения)
0,3..0,15 кислотное выщелачивание
0,15..0,07 карбонатное выщелачивание
3 Кислотное выщелачивание
Извлечение урана из большинства руд прикислотном выщелачивании происходит более полно. Несмотря на то, что для этой цели могут с успехом использоваться как азотная, так и соляная кислоты, чаще всего применяют серную кислоту, вследствие ее доступности и по соображениям экономического характера. Чтобы быть уверенным в полноте извлечения урана, для урановых минералов, содержащих большие количества урана в низших валентных состояниях, при выщелачивании должны быть обеспечены условия окисления. Так как U02 практически не растворим в разбавленной серной кислоте, то уранинит, урановая смоляная руда и руды с большим содержанием урана (IV) должны обрабатываться окислителями, например двуокисью марганца, трехвалентным железом, хлором, хлоратами или молекулярным кислородом.
Основная масса урана из добываемых руд выщелачивается серной
кислотой. Основным недостатком серной кислоты при вскрытии урановых руд является необходимость добавления окислителя. В качестве окислителя можно применять HNO3, MnO2, KClO3 и др. Чаще всего в промышленной практике применяют очищенный природный минерал пиролюзит (MnO2).
При выщелачивании урана из руд, содержащих минералы группы
уранинита – настурана, серной кислотой в присутствии MnO2 протекает
следующая реакция:
U3O8 + 4H2SO4 + MnO2 → 3UO2SO4 + MnSO4 + 4H2O.
Наряду с простым сульфатом в кислой среде образуются комплексные сульфатные анионы уранила [UO2(SO4) 2] -2 и [UO2(SO4)3]4–. Простой сульфат существует в растворах, pH которых больше двух. Константа устойчивости простого сульфата К = 50. Дисульфатный комплекс уранила образуется в растворах, рН которых находится в пределах от 1 до 2. Константа устойчивости этого комплекса К = 350. Трисульфатный комплекс образуется при рН < 1, т.е. в сильнокислых средах. Константа устойчивости трисульфатного комплекса К = 2500. Это значит, что в сильнокислых средах уран находится преимущественно в виде трисульфатного комплекса, мало вероятно существование дисульфатного комплекса и практически отсутствуют простые сульфаты.
|
|
|
В процессе выщелачивания урана из кремнистых руд при повышенных температурах примерно 1 % кремнезѐма вскрывается серной кислотой с образованием труднофильтрующейся кремневой кислоты, что в значительной степени затрудняет дальнейшую переработку пульп и растворов:
SiO2 + H2SO4 → SO4 + H2SiO3.
Глинозѐм в количестве 3 – 5 % от исходного количества переходит в раствор в виде хорошо растворимого сульфата алюминия Al2(SO4)3:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O.
Железо в рудах может содержаться в виде оксидов или карбонатов. Из оксидов железа в серной кислоте легко растворяется Fe2O3, труднее Fe3O4. Карбонат железа FeCO3 легко растворяется. В присутствии окислителя двухвалентное железо окисляется до трѐхвалентного:
2FeSO4 + 2H2SO4 + MnO2 → Fe2(SO4)3 + MnSO4 + 2H2O.
Таким образом, в пульпе железо будет присутствовать в виде Fe2(SO4)3. Растворимость Fe2(SO4)3 вследствие гидролиза ограничена. В горячей воде растворимость не превышает 5 – 7 г/л, поэтому при большем содержании железа оно будет выпадать в осадок в виде Fe(OH)3:
Fe2(SO4)3 + 3H2O → 2Fe(OH)3↓ + 3H2SO4.
4 Карбонатное выщелачивание
Применяется для карбонатных руд и основано на взаимодействии урана с водными растворами карбонатов в присутствии кислорода как окислителя с образованием хорошо растворимых комплексных соединений урана:
U3O8 + 9Na2CO3 +O2 + 3H2O→ 3Na4[UO2(CO3)3] + 6NaOH.
Карбонатные растворы почти не взаимодействуют с минералами пустой породы, поэтому для успешного извлечения урана требуется механическое вскрытие урановых минералов.
|
|
|
Нежелательными примесями при карбонатном выщелачивании являются сульфаты кальция и магния, т.к. они реагируют с содой, что резко увеличивает ее расход.
Применение карбонатного выщелачивания определяется рядом факторов.
1) Во-первых, карбонатное вскрытие значительно более «мягкое», чем кислотное, т.к. большинство примесей не образуют карбонатные комплексы и не переходят в раствор. Чем «мягче» вскрытие, тем меньше расходуется реагент, и тем чище получаются технологические растворы, что упрощает их дальнейшую переработку.
1)
2) Во вторых, карбонатные растворы коррозионно неактивны для аппаратов, что продляет срок их работы.
2)
Но широкому применению карбонатного выщелачивания препятствует ряд недостатков:
• карбонатное выщелачивание требует аэрации и более высокой тонины помола руд, т.к. оболочка из пустой породы практически не
вскрывается карбонатными растворами;
• стоимость соды выше, чем серной кислоты (карбоната натрия
Na2СO3 – в 1,5 раз; карбоната аммония (NH4)2CO3 – в 4 раза);
• карбонатное выщелачивание протекает гораздо медленнее, чем
кислотное выщелачивание; степень извлечения урана при вскрытии
кислотой гораздо выше.
Это приводит к тому, что более распространено кислотное выщелачивание.
Для снижения расхода реагентов и повышения степени извлечения агитационное выщелачивание проводят в прямо- или противоточных каскадах из 3-5 аппаратов (ступеней).
5 Аппаратурное оформление процесса выщелачивания
1) Перколяционный метод
|
|
|


