 |
Химические свойства карбоновых кислот.
|
|
|
|
Кислотные свойства – замещение атома Н в карбоксильной группе на металл или ион аммония.
| 1.Взаимодействие с металлами | 2CH3COOH+Ca à(CH3COO)2Ca+H2 ацетат кальция |
| 2.Взаимодействие с оксидами металлов | 2CH3COOH+BaO à(CH3COO)2Ba+H2O |
| 3.Реакция нейтрализации с гидроксидами металлов | 2CH3COOH+Cu(OH)2 à (CH3COO)2Cu + 2H2O |
| 4.Взаимодействие с солями более слабых и летучих (или нерастворимых) кислот | 2CH3COOH+CaCO3 à (CH3COO)2Ca + H2O + CO2 |
| 4*. Качественная реакция на карбоновые кислоты: взаимодействие с содой (гидрокарбонатом натрия) или другими карбонатами и гидрокарбонатами. В результате наблюдается выделение углекислого газа. 2CH3COOH+Na2CO3 à 2CH3COONa+H2O+CO2 | |
| 2. Замещение гидроксильной группы: | |
| 5.Реакция этерификации | 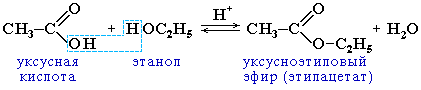
|
| 6.Образование галоген-ангидридов – с помощью хлоридов фосфора (III) и (V). | 
|
| 7. Образование амидов: | 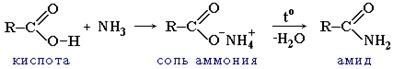
|
| 8. Получение ангидридов. | С помощью Р2О5 можно дегидратировать карбоновую кислоту – в результате получается ангидрид. 2СН3 – СООН + Р2О5 à (СН3СО)2О + НРО3 |
| 3. Замещение атома водорода при атоме углерода, ближайшем к карбоксильной группе (a-углеродный атом) | |
| 9.Галогенирование кислот – реакция идёт в присутствии красного фосфора или на свету. | CH3-COOH+Br2 –(Ркр)à CH2-COOH + НВr ô Br |
| Особенности муравьиной кислоты. | |
| 1. Разложение при нагревании. | Н-СООН –(H2SO4конц,t)à CO + H2O |
| 2. Реакция серебряного зеркала и с гидроксидом меди (II) – муравьиная кислота проявляет свойства альдегидов. | Н-COOH+2[Ag(NH3)2]OHà(NH4)2СО3+2Ag+2NH3+H2O H-COOH + Cu(OH)2 –tà CO2 + Cu2O + H2O |
| 3. Окисление хлором и бромом, а также азотной кислотой. | H-COOH + Cl2 à CO2 + 2HCl |
| Особенности бензойной кислоты. | |
| 1. Разложение при нагревании – декарбоксилирование. |  При нагревании бензойной кислоты она разлагается на бензол и углекислый газ: При нагревании бензойной кислоты она разлагается на бензол и углекислый газ:
 -(t)à + CO2
-(t)à + CO2
|
| 2. Реакции замещения в ароматическом кольце. |   Карбоксильная группа является электроноакцепторной, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
+ HNO3 –(H2SO4)à +H2O Карбоксильная группа является электроноакцепторной, она уменьшает электронную плотность бензольного кольца и является мета-ориентантом.
+ HNO3 –(H2SO4)à +H2O
|
| Особенности щавелевой кислоты. | |
| 1. Разложение при нагревании | 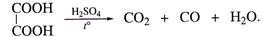
|
| 2. Окисление перманганатом калия. | 
|
| Особенности непредельных кислот (акриловой и олеиновой). | |
| 1. Реакции присоединения. | Присоединение воды и бромоводорода к акриловой кислоте происходит против правила Марковникова, т.к. карбоксильная группа является электроноакцепторной: СН2=СН-СООН + НBr à Br-CH2-CH2-COOH Также к непредельным кислотам можно присоединять галогены и водород: С17Н33-СООН+H2à C17H35-COOH(стеариновая) |
| 2. Реакции окисления | При мягком окислении акриловой кислоты образуется 2 гидроксогруппы: 3СН2=СН-СООН+2KMnO4+2H2O à2CH2(OH)-CH(OH)-COOК + CH2(OH)-CH(OH)-COOH +2MnO2 |
|
|
|
Свойства солей карбоновых кислот.
| 1. Обменные реакции с более сильными кислотами и со щелочами. | CH3-COONa + HCl à CH3-COOH + NaCl (CH3-COO)2Cu + KOH à Cu(OH)2 ↓+ CH3COOK |
| 2. Термическое разложение солей двухвалентных металлов (кальция, магния, бария)- образуются кетоны. | (CH3-COO)2Ca -(t)à CaCO3 + CH3-C-CH3 ǁ O |
| 3. Сплавление солей щелочных металлов со щелочью (реакция Дюма)- получаются алканы. | CH3-COONa + NaOH -(t)à CH4 + Na2CO3 |
| 4. Электролиз водных растворов солей карбоновых кислот (реакция Кольбе). | 2CH3-COONa +2Н2О -(эл.ток)à à C2H6 +2CO2 + H2+2NaOH анод катод |
Свойства галогенангидридов
| 1. Гидролиз – получается кислота. | CH3-COCl + H2O à CH3-COOH + HCl |
| 2. Реакции ацилирования бензола, аминов, солей фенола. |
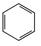  CH3-COCl+ -(AlCl3)àHCl+ CH3-COCl+ -(AlCl3)àHCl+
|
| 3. Получение амидов и сложных эфиров |
 CH3-COCl + NH3 à CH3-CONH2 + NH4Cl
С6Н5-ОNa+ C2H5-C=O -(t)à NaCl + C6H5-O-C=O
\ \
Cl C2H5
CH3-COCl + NH3 à CH3-CONH2 + NH4Cl
С6Н5-ОNa+ C2H5-C=O -(t)à NaCl + C6H5-O-C=O
\ \
Cl C2H5
|
СЛОЖНЫЕ ЭФИРЫ
 – это соединения, содержащие карбоксильную группу, связанную с двумя алкильными радикалами.
– это соединения, содержащие карбоксильную группу, связанную с двумя алкильными радикалами.
|
|
|
Общая формула сложных эфиров такая же, как у карбоновых кислот: CnH2nO2
НОМЕНКЛАТУРА СЛОЖНЫХ ЭФИРОВ. Названия сложных эфиров определяются названиями кислоты и спирта, из которых они образуются.
| Формула эфира | Полное название | Другие названия. |
| СН3-С-ОСН3 ║ О | метиловый эфир уксусной кислоты | метилацетат уксуснометиловый эфир |
| Н-С –ОС2Н5 ║ О | этиловый эфир муравьиной кислоты | этилформиат |
| С2Н5 -С–ОС3Н7 ║ О | пропиловый эфир пропановой (пропионовой) кислоты | пропилпропаноат (пропионат) |
ПОЛУЧЕНИЕ СЛОЖНЫХ ЭФИРОВ.
1)Cложные эфиры могут быть получены при взаимодействии карбоновых кислот со спиртами (реакция этерификации). Катализаторами являются минеральные кислоты.

2) Сложные эфиры фенолов нельзя получить с помощью этерификации, для их получения используют реакцию фенолята с галогенангидридом кислоты:
С6Н5-О-Na+ + C2H5–C=O à NaCl + C6H5–O-C=O
\ \
Cl C2H5
фениловый эфир пропановой кислоты (фенилпропаноат)
|
|
|


