 |
Химические процессы плавки. Межфазные взаимодействия при плавке.
|
|
|
|
Отдельные вещества (компоненты) и однородные совокупности веществ, ограниченные поверхностью раздела (фазы) вступают между собой в различные взаимодействия.
В общем случае можно выделить следующие фазы: газ, твердый металл, твердый углерод, флюс, футеровка, жидкий металл, жидкий шлак.
Взаимодействовать могут компоненты двух и более фаз. Число взаимодействий  определяется числом сочетаний из m по n:
определяется числом сочетаний из m по n:
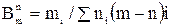 . (28)
. (28)
Таким образом, для общего случая процесса плавки, т.е. когда присутствуют все семь фаз, возможно следующее количество взаимодействий: 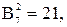
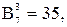
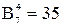 .
.
Большое число возможных сочетаний фаз свидетельствует об исключительной сложности процесса плавки. В реальных условиях на число взаимодействий накладывается ряд ограничений. Наиболее вероятно вступление во взаимодействие двух фаз.
Следующим ограничением, обычно имеющим место, является отсутствие достаточно развитого контакта участвующих фаз и компонентов. Следует отметить, что в плавильном агрегате почти все вещества присутствуют не в одной, а в нескольких фазах и могут вступать в гомогенные и гетерогенные взаимодействия.
Наибольшее влияние на конечный результат плавки оказывает взаимодействие газов, шлака и металла между собой.
Твердые фазы. Для описания строения твердых фаз обычно используют хорошо разработанную в физике твердого тела теорию кристаллического строения вещества. Строение металла как в твердом, так и в жидком состоянии характеризуется наличием металлических связей, что определяет его свойства: электро- и теплопроводность, прочность и т.д. (табл. 2).
Значительное влияние на качество и свойства полученного сплава может оказать строение исходной металлической шихты, так как при плавлении сохраняется ближний порядок в расположении атомов, и поэтому, например, грубая структура чушкового чугуна может при недостаточном перегреве "перейти" в готовый сплав. Это один из признаков наследственности. В связи с этим очень важным является вопрос о степени сохранности структуры исходных твердых фаз. Ее можно приблизительно оценить по размерам кластеров, сохраняющих структуру твердого металла в жидком.
|
|
|
Температура плавления различных составляющих шихты неодинакова: например, чугун эвтектического состава плавится при 1150 0С, а низкоуглердистая сталь, входящая в состав той же шихты, при 1500 0С. Это оказывает влияние на степень разупорядоченности кристаллической структуры. С ростом степени перегрева жидкого сплава над температурой плавления разупорядоченность возрастает, вероятность перехода исходной структуры в структуру сплава при затвердевании уменьшается. Это относится не только к структуре самого сплава, но и к неметаллическим включениям.
Наследственность определяется следующими характеристиками: исходной структурой и составом шихтовых материалов; содержанием, составом, формой и распределением неметаллических включений; содержанием газов; степенью сохранности структуры исходного материала при плавке, т.е. строением уже жидкого сплава.
Углерод в процессах плавки участвует как в виде отдельной фазы, так и в составе металлической фазы, характеризуется кристаллическим строением, наличием нелокализованных химических связей, чем объясняется его электрическая проводимость. Плотность графита 1700-2300 кг/м3, температура плавления 3540 0С и температура сублимации ~5000 0С.
Футеровки выполняют из огнеупорных материалов (табл. 3). Окислы, как правило, составляющие основную массу футеровки, переходят в шлак в результате ее оплавления и оказывают влияние на металлургические процессы плавки. Основой кислых огнеупоров является окись кремния SiO2. Глиноземистые огнеупоры (основа А12O3) по своим свойствам близки к нейтральным. В смеси с SiO2 они являются полукислыми. Основные огнеупоры содержат MgO, CaO и другие основные или амфотерные окислы.
|
|
|
Таблица 3.
Классификация и характеристика огнеупоров
| Тип | Группа | Содержание основных компонентов, % | Огнеупорность, 0C |
| Кремнеземистые | Динасовые | 93-96 SiO2 | 1680-1730 |
| Кварцевые | >98 SiO2 | 1750-1800 | |
| Алюмосиликатные | Полукислые | 65-80 SiO2; 30-17 Al2O3 | 1600-1700 |
| Шамотные | 50-65 SiO2; 45-30 A12O3 | 1600-1700 | |
| Высокоглиноземистые | 46-99 А12O3; <50 SiO2 | 1800-2000 | |
| Магнезиальные | Магнезитовые (периклазовые) | 90-95 MgO | 2300-2500 |
| Доломитовые | 45-60 MgO; 30-35 CaO; 15-5 SiO2 | 1750-1850 | |
| Фостеритовые | 50-55 MgO; 40-35 SiO2 | 1800-1850 | |
| Шпинельные | 25-30 MgO; 65-60 А12O3 | >2000 | |
| Хромистые | Хромомагнезитовые | 10-20 Cr2O3; 70-50 MgO | >2200 |
| Хромитовые | 30-45 CrO3 | 2100-2200 | |
| Цирконосодержащие | Цирконовые | 60-65 ZnO2; 40-45 SiO2 | >2000 |
| Циркониевые | >90 ZnO2 | >2400 | |
| Карборундовые | Карборундовые | 30-95 SiC | - |
В индукционных печах применяют в основном кислую футеровку из кварцита в смеси с борной кислотой. Поверхностный слой футеровки, соприкасающийся с жидким металлом, спекается, образуя борсиликаты.
В вагранках применяют обычно кислую футеровку из шамотных кирпичей. Основную футеровку (из хромомагнезита) используют редко. В сталеплавильных печах применяют как кислую (динас), так и основную (магнезит) футеровку.
В состав флюсов входят окислы, фториды и хлориды (табл. 4).
Таблица 4.
Характеристика основных соединений, входящих в состав флюсов
| Класс соединений | Химическая формула соединения | Температура плавления, 0С | Плотность, кг/м3 |
| Окислы | СаО MgO МnО FeO А12O3 SiO2 | 1610-1720 | 5430-5460 2400-3970 2320-2650 |
| Фторид | CaF2 MgF2 NaF | 2770-1950* | |
| Хлорид | CaCl2 MgCl2 AlCl3 NaCl KC1 | 183** | 2150-2060* 2440-1330* 2170-1550* 1990-1530* |
* В расплавленном состоянии
** Температура сублимации
Жидкие шлаки. В составе шлаков обычно содержатся окислы кремния, алюминия, кальция, магния, железа, марганца и других элементов и соединений, входящих в состав сплава, футеровки и флюсов.
Существует несколько теорий строения шлаковых расплавов. Согласно молекулярной теории, шлак состоит из молекул окислов: SiО2, A12О3, СаО, FeO, MgO, MnO и др. В то же время опытные данные свидетельствуют о том, что в шлаке присутствуют электрически заряженные частицы, и на этой основе развивается ионная теория строения шлаков. В соответствии с этой теорией, шлаки представляют собой ионный раствор, содержащий катионы Са2+, Fe2+, Mg2+ и анионы О2-, SiО42-, А1О33-, РО43-, СrO42-, МоO42-, WO42-, MnO4-, MnO42-, FeO42- и др. Возможность существования тех или иных ионов надо рассматривать, исходя в первую очередь из характера химических связей. Химическая связь тем полярнее, чем больше разность электроотрицательностей ΔЕ участвующих в ней атомов. Иначе говоря, с увеличением ΔЕ увеличивается степень ионности связи, т.е. возрастает эффективный заряд q на атомах. Если абсолютное значение q в долях заряда электрона е больше 0,5, считают, что атомы превратились в ионы, а связь становится ионной. Это происходит при ΔЕ=1,9. Окислы FeO (ΔЕ=1,7), МnО (ΔЕ=2,0), А12O3 (ΔЕ=2,0) и SiO2 (ΔЕ=1,7) находятся как бы на грани между ионными и ковалентными соединениями. Окислы MgO (ΔЕ=2,3) и СаО (ΔЕ=2,5) можно отнести к соединениям с ионной связью.
|
|
|
Шлаки, в составе которых большое количество окиси кремния, могут рассматриваться как силикаты, являющиеся самыми многочисленными минералами в природе (их около четырехсот). Основной структурной единицей всех силикатов и силикатных шлаков является кремнекислородный тетраэдр SiО44-. Тетраэдры SiО44- могут различным образом сочленяться между собой, образуя различные структурные группы. В жидких силикатах сохраняются весьма значительные группировки (кластеры), имеющие ближайший порядок. В шлаке, образующемся при плавке стали и чугуна, имеются кластеры переменного состава 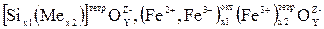 и др.
и др.
Естественно, оперировать в обычных химических расчетах такими громоздкими формулами анионов затруднительно, поэтому для общей характеристики состава и свойств применяются понятия молекулярного строения шлаков, в соответствии с которыми шлаки содержат кислотные окислы, например SiO2, основные окислы СаО, MgO, FeO, MnO и амфотерные окислы А12O3 и др.
Кислотность шлака характеризуется степенью кислотности:
|
|
|
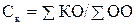 , (29)
, (29)
где ΣКО - сумма кислотных окислов, % по массе; ΣОО - сумма основных окислов, % по массе.
При этом считают шлак сильноосновным при Ск=0,5, основным при Ск=0,5-1,0, средним при Ск=0,5-1,5, кислым при Ск=1,5-3,0,0 и сильнокислым при Ск=3,0.
Величина, обратная Ск, называется степенью основности
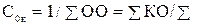 . (30)
. (30)
Для определения основности шлака иногда применяют упрощенные выражения С0=% СаО/% SiO2 или С0=NCaO/NSiO, где NCaO и NSiO - мольные доли окислов.
Свойства шлаков (температура плавления, вязкость и др.) в зависимости от их состава изображают в виде двойных, тройных, а в отдельных случаях даже шестикомпонентных диаграмм.
Вязкость шлаков вторичной плавки литейных сплавов еще мало изучена, например, при плавке чугуна шлаки, имеющие вязкость менее 0,9 Па·с, относятся к очень жидкотекучим; 0,90-1,1 Па·с - к жидкотекучим; 1,5-1,8 Па·с - к недостаточно жидкотекучим (для сравнения напомним, что вязкость жидкого железа 0,005-0,006 Па·с).
Вязкость шлаков в значительной степени зависит от температуры. Так, для шлака, содержащего 40 % SiO2, 10 % А12O3, 35 % СаО и 15 % MgO, при t=1325 0С η=10 Па·с, а уже при t=1500 0С η=0,6 Па·с. Вязкость шлака заметно снижается с увеличением содержания FeO и МnО в шлаке. Значительное снижение вязкости наблюдается при введении в состав шлаков фторидов (CaF2, MgFa). Поверхностное натяжение для жидких окислов составляет 200-500 кДж/м2. Электрическая проводимость расплавленных шлаков обычно находится в пределах 10-100 Ом-1·м-1.
Газовая фаза. В газовой фазе могут присутствовать простые двухатомные газы O2, N2, Н2, газы-окислы Н2O, СO2, СО, SO2, NO и другие газы - СН4, H2S.
Плотность компонентов газовой фазы (1,43 кг/м3 для O2 1,98 кг/м3 для СO2 и 0,09 кг/м3 для Н2) на несколько порядков ниже, чем плотность компонентов конденсированных фаз. Вязкость на два-три порядка ниже, чем вязкость металлов (0,0194 10-3 Па·с для O2).
Для газов характерны ковалентные связи, электрическая проводимость появляется лишь при высоких температурах, близких к температурам перехода газов в состояние плазмы, т.е. ионизированного газа.
Газовая фаза может быть специально создаваемой, активно участвующей в металлургическом процессе, например, в качестве теплоносителя или химического реагента, либо присутствующей при плавке в силу сложившихся условий (например, газовая фаза в индукционной печи).
Источником образования активной газовой фазы является, как правило, горение топлива, главные составные части которого углерод и водород, а также сера:
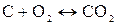 , (31)
, (31)
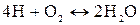 . (32)
. (32)
Углеводороды также сгорают с образованием СO2 и Н2O, например
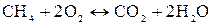 . (33)
. (33)
При температуре выше 1700-1800 0С процесс горения оказывается в значительной степени незавершенным, в газовой фазе присутствуют наряду с СO2 и Н2O продукты неполного сгорания СО и Н2.
|
|
|
В плавильных печах может присутствовать твердый углерод, например, в виде кокса. В этом случае СO2 и Н2O реагируют с углеродом:
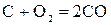 , (34)
, (34)
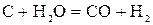 . (35)
. (35)
В формировании газовой фазы участвуют углерод, кислород, водород и азот. Углерод и водород являются восстановителями, а их соединения СO2 и Н2O - окислителями.
Наиболее активный окислитель - кислород. Это объясняется тем, что для электронного строения молекулы кислорода характерно наличие двух неспаренных электронов. Как известно, частицы (атомы, ионы, молекулы), содержащие неспаренные электроны, обладают высокой реакционной способностью. В молекулах Н2 и СО неспаренные электроны отсутствуют.
8. Физико-химические взаимодействия в процессе плавки.
Формируется состав литейного сплава в результате ряда последовательно или параллельно протекающих гетерогенных взаимодействий компонентов различных фаз, участвующих в процессе плавки. Гетерогенное взаимодействие в общем случае состоит из следующих стадий (рис. 2): диффузия исходных компонентов к поверхности раздела; адсорбция на этой поверхности; химическое взаимодействие; десорбция продуктов реакции; диффузия продуктов реакции в одну или обе фазы. Вместо химического взаимодействия может быть переход компонентами поверхности раздела (растворение).
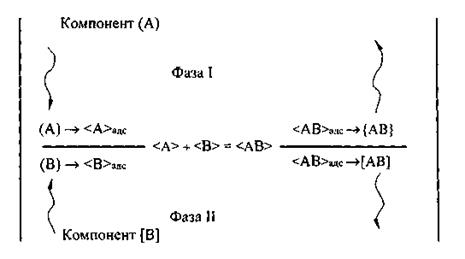
Рис. 2. Общая схема механизма взаимодействия двух фаз
Диффузия происходит в объеме фазы. Переход границы раздела фаз связан с поверхностными явлениями и механизмом химического взаимодействия или растворения.
Состав поверхностных слоев реагирующих фаз также отличается от их состава в объеме фаз. Здесь большую роль могут играть явления адсорбции.
Адсорбцию на поверхности раздела описывают формулой Гиббса:
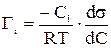 , (36)
, (36)
где Гi - количество адсорбированного вещества, моль/м2; Ci - концентрация, моль/м3; σ - поверхностное натяжение, Дж/м2; R - универсальная газовая постоянная, Дж/(моль·К).
Чтобы вычислить количество адсорбированного вещества по уравнению (36), необходимо определить концентрационную зависимость поверхностного натяжения и найти dσ/dCi. В.А. Григорян рекомендует решать эту задачу методом графического дифференцирования. Для этого требуется построить график зависимости поверхностного натяжения от концентрации и определить угловой коэффициент dσ/dCi в требуемой точке Ci.
Из уравнения (36) следует, что для компонентов, снижающих поверхностное натяжение, т.е. при Гi>0, концентрация Ci на поверхности будет больше, чем в объеме. Итоговая поверхностная концентрация определяется равновесием между силами диффузии, стремящимися ее уравнять, и молекулярными силами на поверхности, стремящимися создать энергетически выгодный поверхностный слой.
Поверхностную концентрацию i-го компонента в растворе можно вычислить по формуле
 , (37)
, (37)
где  и Ni - мольные доли i-го компонента в поверхностном слое и в объеме раствора; ω - поверхность, приходящаяся на 1 моль раствора.
и Ni - мольные доли i-го компонента в поверхностном слое и в объеме раствора; ω - поверхность, приходящаяся на 1 моль раствора.
Поверхностная концентрация может весьма существенно отличаться от объемной. Так, для раствора Мn в Fe при 10 % Мn  =45 %.
=45 %.
Для процессов плавки существенное значение имеет образование жидких растворов - металлического и шлакового. Механизм растворения может быть различным в зависимости от природы растворителя и растворяемых компонентов. Различают химическое, дисперсное и сольватационное растворение. При химическом растворении растворитель и растворяемое вещество вступают в химическую реакцию, в результате которой один из компонентов ее оказывается в растворе. Например, растворение кислорода в шлаковом расплаве, содержащем ионы переменной валентности, основано на этом механизме:
 .
.
Если растворяемое вещество и растворитель образуют ассоциированные группы частиц, процесс называют сольватацией. При этом частицы растворяемого вещества как бы обволакиваются частицами растворителя, образуя комплексы. Например, при растворении извести в кислых шлаках ион Са2+ попадает в окружение ионов 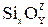 , и образуются комплексы
, и образуются комплексы 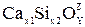 .
.
Химическое взаимодействие происходит на поверхности раздела и является центральным моментом механизма взаимодействия фаз. Многие гетерогенные реакции являются электрохимическими по своей природе. Механизм окисления металла газом через пленку окисла показан на рис. 3. Реагирующий газ X служит катодом, в то время как металл Me - анодом, пленка окисла сульфида или галогенида между газом и металлом - электролитом. Катионы, анионы, так же как и электроны, способны диффундировать через эту пленку.
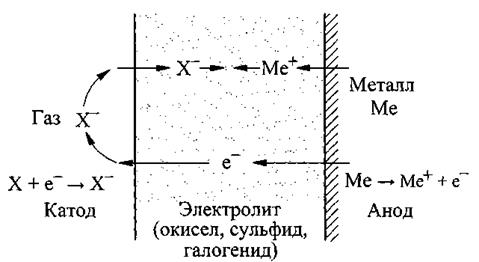
Рис. 3. Схема окисления металла газом
Например, реакция окисления железа Fe+1/2 O2=FeO состоит из двух стадий: катодной 1/2 O2+2е=О2- и анодной Fe-2е=Fe2+.
Наличие ионов Fe2+ в шлаке позволяет развиваться ионообменным реакциям угара С, Si, Mn. При этом катодной стадией является уже восстановление железа: Fe2+2е=Fe, а анодной - окисление примеси с меньшим значением ΔG при данной температуре:
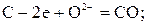

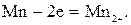
Для каждого электродного процесса Me-Ze→MeZ+ существует определенное значение электродного потенциала
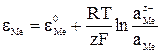 , (38)
, (38)
где εМе - стандартный электродный потенциал для данного металла; F - число Фарадея, равное 96491,4 К; 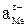 и aMе - активности ионов и атомов металла соответственно в шлаке и металле.
и aMе - активности ионов и атомов металла соответственно в шлаке и металле.
Электродные потенциалы связаны со свободной энергией следующим выражением:
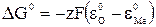 , (39)
, (39)
где 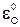 - электродный потенциал кислорода.
- электродный потенциал кислорода.
Для практических целей принимают 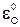 =0 и относительно него рассчитывают шкалу
=0 и относительно него рассчитывают шкалу 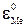 .
.
Значение 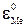 для конкретных условий плавки связано с переходом элементов из шлака в металл или обратно, поэтому кроме ΔG0 образования окисла должна быть учтена ΔG0 для процесса Me→[Me], т.е. перехода элементов в расплав.
для конкретных условий плавки связано с переходом элементов из шлака в металл или обратно, поэтому кроме ΔG0 образования окисла должна быть учтена ΔG0 для процесса Me→[Me], т.е. перехода элементов в расплав.
В состоянии электрохимического равновесия на границе раздела фаз появляется скачок электрического потенциала, а в ионном расплаве шлака создается двойной электрический слой. Притяжение между ионами приводит к появлению за первым слоем избыточных зарядов противоположного знака. Процесс повторяется несколько раз, распространяясь в глубь расплава и постепенно затухая по мере ослабления электростатических сил и выравнивания распределения ионов за счет естественного теплового движения.
Таким образом, механизм гетерогенных взаимодействий весьма сложен и зависит от диффузионных характеристик фаз, поверхностных явлений и явлений, связанных с переходом границы раздела. Механизм процессов тесно связан с их кинетикой.
9. Окисление элементов газовой фазой.
Металлы и сплавы окисляются, контактируя с газовой фазой, содержащей кислород или другие газы-окислители (СO2, Н2O, SO2). Окисляются как твердые металлы и сплавы, так и жидкий расплав. Этот процесс при плавке литейных сплавов играет важную роль, так как в большинстве случаев плавка производится в окислительной атмосфере, и практически для всех металлов ΔG0 реакции Me+1/2 O2=МеО меньше нуля.
Реакции Me+СO2↔МеО+СО и Me+Н2O↔МеО+Н2 протекают менее интенсивно. Например, никель этими газами не окисляется. Кроме того, изменение ΔG надо рассматривать применительно к конкретным сплавам и с учетом аMe, аМеO, рCO, рH2O.
Пример. Требуется провести термодинамический анализ окисления железа из чугуна, содержащего 3,2 % С, 1,8 % Si и 0,6 % Мn, в различных условиях плавки.
Реакции окисления для железа
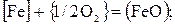 (40)
(40)
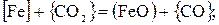 (41)
(41)
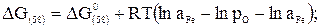 (42)
(42)
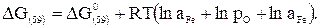 (43)
(43)
Для различных печей давление газов-окислителей различно и соответственно ему подбирается состав шлаков (табл. 5).
Таблица 5.
Состав шлаков для плавильных печей
| Плавильная печь | Парциальное давление газов pi,/ро6щ | Состав шлака, % | |||||||
| O2 | CO2 | CO | SiO2 | Al2O3 | FeO | Mn | CaO | MgO | |
| Вагранка | - | 0,15 | 0,1 | ||||||
| Дуговая печь | 0,07 | 0,11 | 0,015 | ||||||
| Индукционная печь | 0,21 | 0,0003 | - |
Однако термодинамического анализа не всегда достаточно для полной оценки условий плавки. Например, при переплаве небрикетированной стружки, благодаря ее большой поверхности, даже в менее окислительных условиях плавки в коксовой вагранке она окисляется больше, чем в электропечах, так как здесь уже играют роль механизм и кинетика процесса.
Механизм процесса включает следующие стадии: адсорбцию молекул 02 и их диссоциацию O2→2O; катодную стадию О+2е→О2-; диффузию анионов кислорода в пленке окисла; анодную стадию Me-2е→Ме2+; диффузию катионов металла в пленке окисла; образование
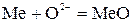 . (44)
. (44)
В начальной стадии химическая реакция определяет скорость процесса. Затем, когда образуется пленка, контролирующей стадией может стать диффузия частиц в окисной пленке, т.е. процесс переходит из кинетического режима в диффузионный.
Окисление элементов на поверхности металлов и сплавов существенно зависит от строения образующейся окисной пленки. Если пленка пористая, то в металл легко проникают частицы кислорода (ионы или даже молекулы), и пленка не препятствует окислению металла. Если же окисная пленка покрывает поверхность металла сплошным плотным слоем, то она обладает защитными свойствами. Например, алюминий имеет высокое сродство к кислороду (ΔG<<0). Однако в атмосферных условиях видимой коррозии не наблюдается. Это объясняется наличием защитной пленки из А12O3. Обычно рассматривают механизм образования пленок исходя из условия сплошности. Если объем образующегося окисла VO больше объема металла VM, израсходованного на его образование, то пленка сплошная и является защитной, если же Vo/Vm<1, то пленка не может быть сплошной.
Только щелочные и щелочноземельные металлы не удовлетворяют условиям сплошности. При плавке или введении в сплавы нужно принимать особые меры по защите их от окисления. Однако условие сплошности является необходимым, но недостаточным для защиты металлов от окисления. Если в пленке возникают большие внутренние напряжения, то она может разрушаться. Считают, что если (Vo/Vm)max≥2,5, то пленка не будет защитной (МоO3, WO3).
Окисление твердых металлических составляющих шихты при их нагреве, а затем и жидкого сплава влияет на угар элементов, являющихся одним из важнейших показателей плавки.
10. Взаимодействие металла в шлаке.
Между металлом и шлаком возможны, например, следующие реакции:
 , (45)
, (45)
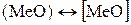 , (46)
, (46)
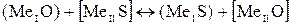 , (47)
, (47)
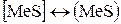 , (48)
, (48)
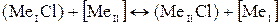 , (49)
, (49)
 . (50)
. (50)
Термодинамический анализ взаимодействия металла и шлака необходимо выполнять путем расчета значений ∆G с учетом активности всех компонентов для конкретных литейных сплавов.
Механизм процессов окисления металла шлаком связан с переносом кислорода из атмосферы через шлак к металлу. Простые и комплексные ионы могут иметь переменную валентность, что способствует переносу кислорода из атмосферы к металлу. В связи с этим для обеспечения защитных свойств шлака в его составе не должно быть ионов переменной валентности. Кислород, находящийся в шлаке в виде CaO, MgO, не является окислителем.
Распределение элементов или соединений между металлом и шлаком подчиняется закону распределения, согласно которому при постоянной температуре отношение концентраций растворенного вещества в двух несмешивающихся жидкостях является величиной постоянной:
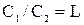 , (51)
, (51)
где L - константа распределения.
Значение константы определяется природой растворителей, растворенного вещества и температурой. Зависимость L от температуры
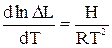 , (52)
, (52)
где ∆Н - изменение энтальпии при переходе растворенного вещества из одной жидкости в другую.
Закон распределения используется для описания ряда важных процессов, протекающих при плавке литейных сплавов.
11. Взаимодействие расплавов с углеродом.
Углерод может растворяться в металле или вступать с ним во взаимодействие, образуя карбиды или восстанавливая окислы. Большинство металлов при высоких температурах могут быть восстановлены углеродом по реакции
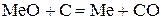 . (53)
. (53)
Для условий восстановления чистого окисла (aMeO=1) термодинамический анализ легко произвести непосредственно по диаграмме ∆G0-Т. При температурах правее точки пересечения линий ∆G0-Т для реакций 2С+O2=2СО и 2Ме+O2=2МеО металлы восстанавливаются. Если окисел находится в растворе, нужно учитывать его активность.
Механизм и кинетика взаимодействия углерода с расплавами зависят от того, в каких условиях оно происходит. Возможны следующие варианты:
углерод восстанавливает окислы, растворенные в металле; этот процесс называют раскислением, его механизм и кинетика связаны с образованием и удалением газовых пузырей СО;
углерод восстанавливает окислы из шлака; эти реакции, как все реакции с участием окислов в шлаках, относятся к электрохимическим и рассматриваться аналогично реакциям на поверхности металл - шлак;
углерод растворяется в металле; тогда необходимо рассматривать два момента: предельную растворимость углерода и условия его растворения.
Растворимость углерода в железе определяется следующей зависимостью: [% С]нас=1,34+2,54·10-3t.
Условия растворения углерода могут быть различными в зависимости от вида плавильного агрегата. Скорость процесса зависит от интенсивности перемешивания, температуры и состава расплава, вида карбюризатора.
12. Взаимодействие расплава с футеровкой печи.
Шлак и металл взаимодействуют с футеровкой печи, обычно выполняемой из окисных огнеупоров 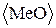 . При этом возможны реакции:
. При этом возможны реакции:
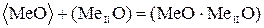 ; (54)
; (54)
 ; (55)
; (55)
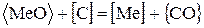 ; (56)
; (56)
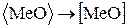 ; (57)
; (57)
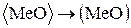 . (58)
. (58)
Реакции (54) и (58) описывают взаимодействие футеровки с окислами шлака. При этом возможно либо химическое взаимодействие по реакции (54), либо растворение окисла в шлаке (58). Такое взаимодействие широко распространено в вагранках. Футеровка вагранок “выгорает”, так как шлак, стекая по стенкам, разъедает футеровку (54) и (58).
Взаимодействие футеровки с металлами (55)-(57) также приводит к износу футеровки и переходу в металл различных элементов. Например, алюминий может реагировать с огнеупорами
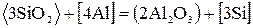 . (59)
. (59)
Компоненты железоуглеродистых сплавов также взаимодействуют с футеровкой. Большое значение имеет равновесие тигельной реакции
 , (60)
, (60)
которое в зависимости от температуры характеризуется диаграммой равновесных значений [Si] и [С].
Перегрев расплава выше равновесных температур и благоприятные условия образования пузырьков СО могут привести к тому, что реакция (60) будет протекать весьма интенсивно, что нежелательно. В связи с этим при ведении плавки необходимо соблюдать определенный режим перегрева, соответствующий составу сплава, или подбирать состав футеровки так, чтобы по возможности исключить взаимодействие расплава с футеровкой.
Правильный выбор футеровки и режима плавки обеспечивает минимальное развитие реакций (54-58). Полностью исключить взаимодействие футеровки с расплавом можно только при плавке в водоохлаждаемых тиглях на гарнисаже; в данном случае “футеровкой” является сам сплав, застывший в виде гарнисажа. К этому методу плавки прибегают лишь в тех случаях, когда расплав очень активен и интенсивно взаимодействует с любыми огнеупорами, загрязняя сплав и резко ухудшая его качество.
ЛЕКЦИЯ 4
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПЛАВКИ (ОКОНЧАНИЕ)
План лекции.
24.Рафинирование.
25.Флюсование.
26.Легирование.
27.Модифицирование.
Обрабатывают сплавы вводом добавок или методами внешнего воздействия (рис. 1) с целью модифицирования, легирования, раскисления, рафинирования.
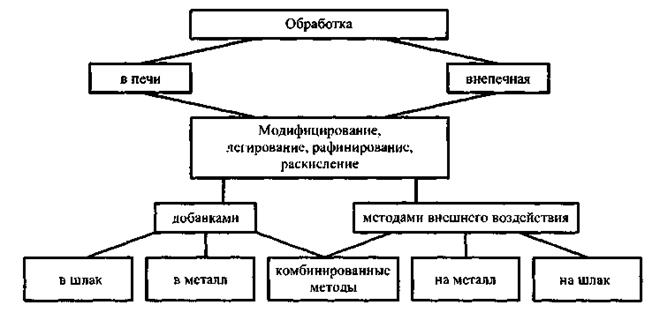
Рис. 1. Классификация процессов обработки расплавов
Добавки могут быть: газообразными (О, N, НТ - нейтральные газы); твердыми (М - металлы или другие чистые вещества, элементы или соединения, С - смеси, Л - лигатуры, Ф - флюсы); жидкими (Ф - флюс, Ш - шлак).
Устройства для ввода добавок: дозаторы (Д), труба для продувки сверху (ПГВ), пробка для продувки снизу (ПГН), устройство механического ввода, например прутка (MB), зарядная камера (ЗК), испаритель (И), колокол (К), в которые помещают модификатор.
Места, где осуществляется обработка: печь (П) и внепечные желоб печи (ВЖ), открытый ковш (ОК), герметичный ковш (ГК), литейная форма (Ф), рабочая камера в литниковой системе (РК).
Для внешнего воздействия применяют специальёные устройства (СУ): для фильтрации (УФ); вакуумкамеры (ВК); автоклав (А); вибрационные (ВУ); ультразвуковые (УЗ); перемешивающие (МП); электрические (ЭУ).
Число возможных сочетаний очень большое. Например: Л U РК U Ф (модифицирование лигатурой в форме); Л U Д U ВЖ (лигатурой через дозатор на желобе) и т.д.
1. Рафинирование.
Рафинирование - очистка от вредных примесей. Даже при точном выполнении процесса плавки в расплаве остаются примеси, попавшие с шихтой, образующиеся в результате взаимодействия расплава с футеровкой, атмосферой, шлаком и т.д. Примеси бывают трех видов: растворимые металлические; взвешенные неметаллические; газообразные.
Способ рафинирования выбирают в зависимости от состава сплава, вида примесей. Основные способы: окисление, флюсование, дегазация, фильтрация или комбинированные методы.
Окислением очищают расплавы в печи от растворимых металлических примесей (медь от Pb, Fe, Ni, As, Vi, Sb, а никель - от Si, S, Mg, Mn и др.). Продувкой воздухом очищают сплавы железа от С, Si, P, Мn.
Добавка должна иметь большее средств к кислороду (S, Cl, F), чем рафинируемый расплав. Например, для удаления серы из стали и чугуна вводят добавки лучше взаимодействующие с серой, чем с железом:
FeS+СаО=CaS+FeO,
FeS+Mg=MgS+Fe.
При удалении фосфора из стали и чугуна протекают следующие реакции:
2Р+5FeO=Р2O5+5Fe,
3FeO+P2O5=(FeO)3·P2O5,
(FeO)3·P2O5+4СаО=СаО)4·Р2O5+3FeO
При продувке печи воздухом, кислородом или вводом окисляющихся флюсов (наведением шлака заданного состава) проходит реакция рафинирования методом окисления.
Для внепечной обработки применяют синтетические шлаки (отдельно выплавленный и перелитый в ковш, в который затем переливают расплав).
2. Флюсование.
Флюсы - это в основном материалы минерального происхождения. Покровные флюсы предохраняют твердую шихту от окисления, а расплав от контакта с атмосферой. Рафинирующие флюсы содержат химически активные компоненты, которые образуют с примесями нерастворимые соединения, и ошлаковывающие вещества, которые обволакивают твердые примеси и выносят их в шлак. Иногда используют покровно-рафинирующие флюсы, как например смесь хлоридов и фторидов для алюминиевых сплавов. Флюсование может быть верхнее, нижнее и по всему объему в зависимости от плотности примесей. Очень важно, чтобы флюсы лучше смачивали примеси, чем расплав; поверхностное натяжение флюсов должно быть минимальным.
Дегазация. Если газ с металлом при кристаллизации образует твердые растворы, то на качество отливок это сильно не влияет. Если же газ с металлом образует жидкие растворы, то затем он выделяется, образуя поры или раковины.
Поэтому проводят дегазацию шихтовых материалов, жидкого металла вакуумированием, продувкой расплава газами, обработкой хлоридами, выдержкой в атмосфере инертных газов, физическим воздействием на жидкий металл, а также предупреждают выделение газов при кристаллизации.
Вакуумирование.
По закону Сивертса
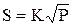 , (1)
, (1)
где S - растворимость газов; К - коэффициент пропорциональности; Р - давление над металлом, чем больше Р, тем меньше S.
Создание разрежения над металлом сопровождается понижением температуры кипения и усилением выделения газа из металла. С пузырьками газов из расплава выносятся в шлак и твердые включения.
Вакуумирование широко применяют для дегазации медных, алюминиевых, никелевых и специальных сплавов. Сплавы с легкоиспаряющимися компонентами не вакуумируют, т.к. они испаряются вместе с газами.
Продувка газами. Промывные газы делятся на инертные (например N, Аr, Не) к сплаву и активные (хлор). В пузырьки промывного газа диффундируют растворенные в металле газы. Чем мельче пузырьки промывного газа, тем медленнее они всплывают и больше собирают газовых пузырьков из металла, а заодно и твердых включений.
Продувка азотом используется для рафинирования Al, Cu, Mg.
Алюминиевые сплавы эффективнее рафинируются хлором. Образуются газообразные А1С13 и НС1. Однако хлор токсичен и из-за опасности процесса применение его ограничено.
После продувки сплав выдерживают 10-15 мин для окончательного выхода на поверхность расплава даже очень мелких пузырьков газов. Продувкой газами обрабатывают, главным образом, алюминиевые сплавы.
Обработка хлоридами. Механизм тот же, что и при продувке газами, только используют хлориды Zn, Al, Mn, В и др. Твердые хлориды вводят на дно ванны, жидкие - в объем.
|
|
|


