 |
Свойства влаги как основного компонента пищевых продуктов
|
|
|
|
Вода является самым распространенным, но наименее изученным соединением на Земле. Помимо того, что она входит в состав всех биологических материалов, она образует естественную среду обитания для бесчисленного множества видов животных. Свойства воды меняются в зависимости от происхождения (дождевая, ледниковая, речная и т. п.), географического места взятия пробы, температуры и давления, наличия растворенных солей и прочих веществ, объекта, в состав которого она входит, и его влагосодержания.
За последние два десятилетия интерес к воде непрерывно растет. Возрастает число исследований, посвященных изучению свойств воды, создаются лаборатории и центры, предназначенные для изучения изменений, которые претерпевает вода под действием физических наложений.
Известно, что вода обладает некоторыми специфическими аномальными свойствами. Относясь к ряду, в который входят Н2О, H2S, H2Se и другие соединения, она обладает максимальной энергией связи, значительной способностью к деформации, большой вязкостью и сравнительно малой теплопроводностью. Молекула воды легче и меньше других представителей этого ряда. Вода является одним из немногих веществ, которые при замораживании расширяются, ее плотность максимальная при температуре +4° С.
Применение новейших методов исследования (ядерный магнитный резонанс, электронная микроскопия, дифференциальный термический анализ и т. д.) позволило достоверно определить свойства и состояние воды в биологических материалах.
Молекулярная структура воды. Известный венгерский биолог Сент-Дьердьи пишет: «Странное вещество — вода. Она обладает свойствами капризно изменять молекулярную структуру».
|
|
|
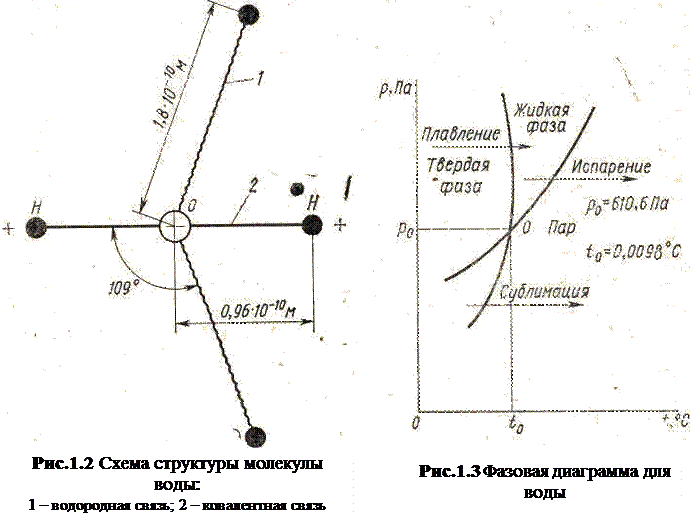
В настоящее время существует множество моделей структуры воды, но ни одна из них полностью не объясняет всех свойств вещества.
Важнейшим свойством молекулы воды (рис. 1.2) является способность образовывать водородные (межмолекулярные) связи значительно менее прочные, чем ковалентные. Так, энергия ковалентных связей составляет 580·103 Дж/моль, в то время как водородных — 5·103.., 28·103 Дж/моль, при этом период жизни каждой водородной связи ничтожно мал и составляет 10-10 с. Таким образом, межмолекулярные связи образуются и мгновенно исчезают. Благодаря лабильным водородным связям становится возможным осуществление различных биомолекулярных процессов, характерных для объектов биологического происхождения.
Интересна модель Самойлова, согласно которой структура воды в жидком состоянии во многом похожа на структуру льда (тетраэдрическую), несколько размытую тепловым движением молекул. В структуре воды различают две фракции — решеточно-упорядоченную (ажурный каркас) и плотно упакованную, причем последняя образуется за счет заполнения пустот решеточно-упорядоченной структуры отдельными молекулами воды, слабо взаимодействующими с молекулами, образующими наружный каркас. Этим объясняется максимальная плотность воды при температуре + 4°С, когда с ростом температуры после таяния льда количество заполненных полостей увеличивается. Молекула воды в пустотах по своим энергетическим значениям занимает промежуточное место между молекулами воды и газа.
Агрегатные состояния воды. Агрегатные состояния воды, как и других веществ,- являются функцией температуры и давления.
Агрегатные состояния воды при атмосферном д а в л е н и и. Целесообразно рассмотреть в первую очередь общеизвестную фазовую диаграмму (рис. 1.3), на которой представлена кривая, p = f(t), где р — парциальное давление пара над поверхностью воды или льда; t - температура, °С.
|
|
|
Диаграмма на рис. 1.3 отражает условия равновесия между различными фазами воды в диапазоне рассматриваемых давлений 0... 0,1 МПа. В этой диаграмме также представлена зависимость p = f(t) для переохлажденной воды. Равновесное давление пара над переохлажденной водой выше, чем надо льдом (при той же температуре), поэтому переохлажденная вода термодинамически неустойчива и может перейти в твердое состояние, если в нее поместить кристалл.
При атмосферном давлении и соответствующих температурах могут существовать три фазы воды: твердая при  °C, жидкая при 100°C
°C, жидкая при 100°C  0°С, газообразная при
0°С, газообразная при  100°С. Из трех агрегатных состояний наибольший интерес для процессов консервирования имеет твердое, возникающее при понижении температуры системы до уровня, при котором создаются соответствующие условия для фазового перехода жидкость — твердое вещество.
100°С. Из трех агрегатных состояний наибольший интерес для процессов консервирования имеет твердое, возникающее при понижении температуры системы до уровня, при котором создаются соответствующие условия для фазового перехода жидкость — твердое вещество.
Понижение температуры приводит к замедлению движения частиц, причем у жидкостей первого рода (стекло, глицерин) сокращаются перемещения центров колебательного движения, а у жидкостей второго рода (вода и др.) — амплитуда и скорость колебательного движения. Жидкости первого рода «сгущаются» (растет вязкость), и в конечном итоге возникает твердая аморфная структура —стеклообразное, или верифицированное, состояние. Жидкости второго рода переходят в твердое кристаллическое состояние.
Вода относится к жидкостям второго рода, но при определенных скоростях охлаждения наряду с кристаллической структурой может возникнуть аморфная структура вещества. Кристаллы образуются при определенном соотношении энергии броуновского движения Эб и энергии ориентации частиц Э0. При этом кристаллизация исключена, если Эб>Э0, возможна, если Эб  Э0 наступает обязательно при Эб<Э0.
Э0 наступает обязательно при Эб<Э0.
Агрегатное состояние воды при давлении ниже атмосферного. Изменение внешнего давления приводит к изменению закономерностей, характеризующих фазовые переходы при атмосферных условиях. При общем давлении р в системе более 6,1·102 Па (тройная точка воды) возможно сосуществование фаз вещества - твердого, жидкого и парообразного (газообразного).
При р <6,1·102 Па возможно существование только двух фаз — твердой и парообразной.
|
|
|
 При вакуумировании функциональная связь p = f(t) четко соблюдается. По мере понижения общего давления парциальное давление пара, являясь частью общего, также снижается, а это сопровождается понижением температуры воды. Когда общее давление становится меньше 6,1·102 Па, температура воды достигает 0°С, после чего наступает ее кристаллизация (или переохлаждение). Дальнейшее снижение общего давления приводит к охлаждению льда до температуры, при которой устанавливается равновесие между давлением пара над поверхностью льда и в окружающем вакуумном пространстве.
При вакуумировании функциональная связь p = f(t) четко соблюдается. По мере понижения общего давления парциальное давление пара, являясь частью общего, также снижается, а это сопровождается понижением температуры воды. Когда общее давление становится меньше 6,1·102 Па, температура воды достигает 0°С, после чего наступает ее кристаллизация (или переохлаждение). Дальнейшее снижение общего давления приводит к охлаждению льда до температуры, при которой устанавливается равновесие между давлением пара над поверхностью льда и в окружающем вакуумном пространстве.
Агрегатное состояние воды при давлении выше атмосферного. В условиях давлений выше атмосферного закономерность приобретает сугубо специфический характер, особенно когда давление превышает критическое
(ркр =22,5 МПа). Область высоких давлений (для воды) до настоящего времени мало изучена.
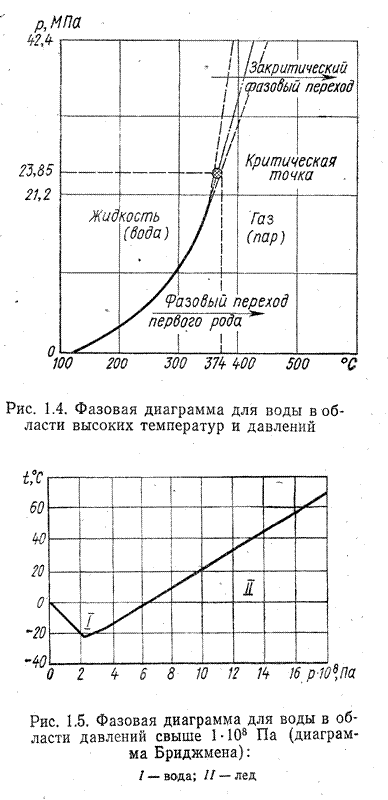
Начнем рассмотрение закономерностей с диаграммы p=f(t) для интервала температур 100...500°С (рис.1.4). При атмосферном давлении температура кипения воды составляет 100°С. С повышением давления температура кипения возрастает, однако за пределом критических параметров (ркр =22,5 МПа, t = 374°C) исчезает различие между жидким состоянием и паром (закритический фазовый переход).
Возникает область наименьшей термодинамической устойчивости, в которой вода становится веществом непрозрачным, с губчатой структурой (четвертое состояние, т. е. «плазма»). Левее и правее области закритического фазового перехода на фазовой диаграмме находятся области обычного жидкого или газообразного состояния вещества.
Рассмотрим теперь диаграмму (рис. 1.5), на которой представлены фазовые состояния воды при давлении свыше 1·103 МПа. В этих условиях наибольший интерес представляют две области: первая лежит в интервале давлений до 600МПа и температур до —20° С. В этой области (I) вода не кристаллизуется и сохраняет жидкое состояние при отрицательных температурах. Таким образом, открывается возможность консервации биологических материалов при низких температурах без возникновения необратимых явлений (разрушений), вызываемых кристаллизацией.
|
|
|
Вторая область (II) охватывает интервал давлений, превышающих 600 МПа и температур, ограниченных кривой фазовых переходов. В этих условиях образуется твердая кристаллическая фаза с температурой выше 0°С. Так, при давлении 1·103 МПа «лед» имеет температуру +20° С, а при давлении 1,6·103 МПа — температуру +55° С. Естественно, что создание столь высоких давлений представляется исключительно серьезной технической задачей, поэтому сегодня трудно ответить на вопрос о перспективах использования «горячего льда». Вместе с тем нет сомнений, что создание соответствующих технических средств явится толчком для разработки новых высокоэффективных способов и процессов обработки продуктов и материалов.
|
|
|


