 |
Министерство образования и науки Российской Федерации
|
|
|
|
Для группы Z3,5ХТ-21
Вариант 1
1. Что такое кайно- и некайносимметричные орбитали и электроны? Приведите примеры кайносимметричных и некайносимметричных орбиталей. Укажите в Периодической системе места, где расположены атомы, содержащие кайносимметричные орбитали в нормальном (невозбужденном) состоянии. Каковы особенности пространственного распределения электронной плотности кайносимметричпых орбиталей?
2. Для водородоподобного атома найти кратность вырождения k уровня с номером n.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 15 и 23. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: CO, H2SO4. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: MnCl2, CaC2. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: IF7, SO32-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 2
1. Орбитальные радиусы атома марганца и некоторых его катионов имеют следующие значения, нм:
|
|
|
Мn: 0,128; Мn2+: 0,039; Мn4+: 0,038.
Как можно объяснить:
а) уменьшение радиусов при переходе от Мn к Мn4+?
б) значительно более резкое уменьшение радиуса при переходе от Мn к Mn2+,чем при превращении Мn2+ в Мn4+?
2. Для водородоподобного атома найти явный вид волновых функций состояний со значением главного квантового числа n = 2. Показать, что эти функции нормированы на единицу.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 19 и 34. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: CO2, H2SO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: NaCl, OsO4. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: CN-, PF5. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 3
1. Не пользуясь справочными данными, предскажите изменение радиуса частиц при следующих превращениях:

Обоснуйте ответ.
2. Найти среднее значение rk (k = −1,0,1,2,...) в 2 s -состоянии водородоподобного атома.
3.Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 6 и 47. Распределить валентные электроны по атомным орбиталям:
|
|
|
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: N2O5, H2SiO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: Na2O, SiH4. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [ZrF7]3-, NO3-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 4
1. Замечено, что для бинарных водородных соединений р -элементов вторичная периодичность не проявляется. Убедитесь в этом, построив график изменения стандартных энтальпий образования галоидоводородов Δ H Fо, кДж/моль, в зависимости от природы галогена, воспользовавшись данными: HF:– 271; HCI: – 92; HBr: – 36; HI: +26.
Объясните причину излома на полученном графике.
Подтвердите справедливость этого утверждения, воспользовавшись справочными данными для бинарных соединений водорода и элементов других групп р-элементов.
2. Записать волновую функцию основного состояния водородоподобного атома в импульсном представлении.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 9 и 52. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
|
|
|
4. Методом валентных связей показать образование связей в следующих соединениях: Cl2O7, NH3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: SO3, AsH3. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: IF5, [CoF6]3-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 5
1. Диагональное сходство некоторых элементов проявляется как своеобразный равнодействующий результат увеличения ионизационных потенциалов элементов в горизонтальных рядах системы и их уменьшения по вертикали. В результате получается компенсация этих влияний и, следовательно, функциональное сходство атомов, лежащих на диагонали. На основании расчета силовых характеристик покажите,что диагональное сходство должно проявляться в парах элементов Li-Mg, Na-Ca, K-Sr, Rb-Ba, Cs-Ra,, Ti-Nb, V-Mo и других (каких еще?) и выражается в явлении изоморфизма.
2. Записать операторы L + и L − в Lz -представлении для системы с орбитальным моментом l =1.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 12 и 37. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: SiO2, HClO4. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: HI, MoO3. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
|
|
|
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: BeCl2, XeF4. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 6
1. Обратные диагональные пары, объединяющие элементы в направлении справа – вниз – налево (например, S–As, Se–Sb, Те–Вi) проявляют определенное сходство в халькогенидах. Природа этого явления не ясна.
а) Приведите как можно больше примеров проявления сходства элементов в указанных парах.
б) Предложите возможные объяснения причин обратно-диагонального сходства.
2. Нормировать спиновые волновые функции:

3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 20 и 31. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: Al2O3, AsH3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: CaCl2, CO2. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: CO32-, PCl5. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 7
1. Рассмотрите проявление диагонального сходства между литием и магнием на примерах получения и химических свойств оксидов, нитридов, гидроксидов, карбонатов, фторидов, ортофосфатов, перхлоратов.
2. Пользуясь явным видом матриц Паули, проверить справедливость следующих выражений: 
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 5 и 59. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
|
|
|
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: MgO, HClO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: H2O, NaI. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [MnCl5]3-, HgCl2. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 8
1. Проиллюстрируйте диагональное сходство бора и кремния на примере гидролиза их хлоридов. В чем отличие характера гидролиза хлоридов бора и алюминия, являющихся групповыми аналогами?
2. Упростить выражение  , где n – целое неотрицательное число, a – вещественный числовой вектор.
, где n – целое неотрицательное число, a – вещественный числовой вектор.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 8 и 33. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: Na2O, MgCO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: HF, CaS. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: SF6, ClO3-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 9
1. Проведите широкое сопоставление свойств элементов, проявляющих диагональное сходство, пользуясь справочным и монографическим материалом (литий-магний, берилий-алюминий); при этом воспользуйтесь следующим примерным планом сопоставления:
а) физические и химические свойства простых веществ;
б) свойства оксидов и гидроксидов;
в) свойства бинарных соединений: гидридов, нитридов, карбидов;
г) свойства солей (в частности галидов, карбонатов, фосфатов, перхлоратов и т. д.);
д) свойства катионов в водных растворах.
2. Вычислить квадрат проекции спина 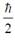 на произвольное направление.
на произвольное направление.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 26 и 31. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: CaO, H3PO4. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: MgCl2, NiO. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [Ni(CN)5]3-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 10
1. Экспериментально установлено, что элементы второго периода образуют намного более прочные π-связи, чем элементы других периодов. Предложите возможное объяснение этого экспериментального факта.
2. Существует ли оператор, обратный оператору дифференцирования  ?
?
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 28 и 32. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: CrO3, BaSO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: CaO, PCl3. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [Ag(CN)2]-, SO3. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 11
1. Правило числа соседей Юм-Розери, связывающее состав молекул элементов с их положением в Периодической системе, гласит: число соседей у атома неметалла в молекуле равно разности (8 - N), где N - номер группы в системе. Под «соседями» подразумеваются соседние атомы, с которыми может быть связан любой атом молекулы ординарными ковалентными связями. На основании этого правила ответьте на следующие вопросы:
а) Почему молекулы инертных газов одноатомны?
б) Почему молекулы галогенов двухатомны?
в) Почему молекула фосфора имеет пирамидальное строение?
г) Почему многоатомные молекулы серы имеют кольцеобразное строение?
2. Найти: 
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 11 и 60. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: Mn2O7, HNO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: SnO, FeS. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: BeF2, [CoF6]3-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 12
1. Что можно сказать о способности к комплексообразованию ионов s -элементов второй группы по сравнению с ионами s -элементов первой группы? Какой из ионов s -элементов второй группы должен давать наиболее прочные и разнообразные комплексные соединения и почему? Как должна изменяться способность к комплексообразрванию в ряду щелочноземельных элементов от кальция до радия? Приведите известные Вам примеры комплексных соединений рассматриваемых элементов и охарактеризуйте их свойства, пользуясь справочным материалом.
2. Рассчитать 
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 3 и 67. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: P2O5, AlCl3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: SnO2, Na2S. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [Ni(CN)5]3-, PCl5. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 13
1. Ионы лития и магния в присутствии избытка аммиака способны образовывать в водном растворе довольно устойчивые комплексные аммиакаты. Ион бериллия вследствие своего малого размера создает вокруг себя поле высокой напряженности, и следовало бы ожидать, что и он тоже должен давать аммиакаты, устойчивые в водном растворе, однако такие комплексы для него не обнаружены. Объясните возможную причину такого «аномального» поведения иона бериллия.
2. Доказать, что 
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 14 и 49. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: B2O3, Fe(OH)2. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: BeO, PCl5. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [V(CN)7]4-, [PtCl4]2-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 14
1. Несмотря на весьма различные химические свойства ионов щелочных металлов, ионов галогенов и инертных газов с точки зрения способности к комплексообразованию эти три группы веществ проявляют явное сходство: все они характеризуются слабо выраженными комплексообразующими свойствами и, кроме малочисленных и непрочных комплексных ионов, образующихся за счет координации молекул воды, других комплексных соединений, как правило, не дают.
а) Чем можно объяснить это сходство в отношении комплексообразования у указанных групп веществ?
б) Какую закономерность в изменении устойчивости аквакомплексов можно ожидать в ряду галогенидионов от фтора до иода?
2. Доказать, что средние значения эрмитовых операторов  в произвольном состоянии неотрицательны.
в произвольном состоянии неотрицательны.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 2 и 75. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: BeO, KMnO4. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: FeO, CuS. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [Cu(NH3)2]+, BF3. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 15
1. Известно, что ион аммония NH4+ во многих отношениях имеет свойства, близкие свойствам ионов s-элементов первой группы, особенно К+. Приведите как можно больше примеров как сходства, так и различия физико-химических свойств этих ионов и содержащих их соединений. С чем можно связать сходство рассматриваемых ионов?
2. Найти собственные значения и собственные функции оператора импульса 
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 22 и 51. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: K2O, Fe(OH)3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: OF2, AgF. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [Pt(NH3)2Cl2]0, NH4+. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 16
1. Постройте график зависимости атомного радиуса, первого потенциала ионизации и сродства к электрону от порядкового номера для атомов р -элементов шестой группы. Подробно опишите ход кривых и объясните его.
2. Построить гамильтониан двумерного изотропного гармонического осциллятора в декартовой системе координат. Масса осциллятора M, а частота ω.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 16 и 38. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: Ag2O, Na2CO3. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: N2O, CsF. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: ClO3-, [Fe(CO)5]. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
Вариант 17
1. Металлические свойства s -элементов I группы от лития к цезию возрастают, а электропроводность металлов в этом же ряду уменьшается. С чем это можно связать?
2. Построить гамильтониан атома водорода, перейдя в систему центра масс. Масса ядра атома равна M 1, а масса электрона M 2.
3. Записать полные и краткие электронные формулы элементов, составить электронно-графические формулы элементов, находящихся в таблице периодической системы элементов Д.И. Менделеева под номерами 26 и 44. Распределить валентные электроны по атомным орбиталям:
а) в нормальном состоянии (найти значения квантовых чисел для последнего электрона);
б) в возбужденном состоянии атома (найти значения квантовых чисел для последнего электрона);
Определить к какому электронному семейству относится элемент.
4. Методом валентных связей показать образование связей в следующих соединениях: ZnO, K2Cr2O7. Какие связи образуются? Нарисовать структуры соединений в пространстве.
5. Методом молекулярных орбиталей показать образование связей в следующих соединениях: NO2, SiC. Определить магнитность соединений, кратность связей. Нарисовать структуры соединений в пространстве.
6. Определить тип гибридизации, состав и свойства молекулы, геометрию гибридных облаков, электронные пары следующих соединений: [HgI3]-, [MnCl4]2-. Объяснить и показать, используя методы образования химических связей. Нарисовать молекулы в пространстве.
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
СТЕРЛИТАМАКСКИЙ ФИЛИАЛ
|
|
|


