 |
Наиболее полно исследованы спектры излучения атома водорода
|
|
|
|
Модель Резерфорда не давала
ответы на вопросы:
- Почему атом является
устойчивой системой?
- Почему спектры излучения
атомов линейчатые, а не сплошные?
1913 г Н. Бор.
«квантовая модель строения атома»
Постулаты Бора:
|
Теория Бора позволяет рассчитать:
1. радиус стационарной орбиты:
rn =  2. энергию на любом энергетическом уровне:
Е n =
2. энергию на любом энергетическом уровне:
Е n =  3. скорость электрона на орбите:
υn =
3. скорость электрона на орбите:
υn = 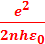
|
me υn rn = 
n – главное квантовое число, n = 1, 2, 3….
Экспериментальные данные позволившие построить квантовую модель.
 (не зависит от длины волны падающего света).
Сдвиг длин волн: Δλ = λ1 - λ0
Δλ = 2λк sin2 θ
· 1923 г. Луи де – Бройль – высказал гипотезу, что любая частица обладает одновременно волновыми и корпускулярными свойствами.
Любой частице, обладающей импульсом, соответствует длина волны де – Бройля.
· λБ = (не зависит от длины волны падающего света).
Сдвиг длин волн: Δλ = λ1 - λ0
Δλ = 2λк sin2 θ
· 1923 г. Луи де – Бройль – высказал гипотезу, что любая частица обладает одновременно волновыми и корпускулярными свойствами.
Любой частице, обладающей импульсом, соответствует длина волны де – Бройля.
· λБ =  · 1927 г. Джозеф Томсон – наблюдал дифракцию потока электронов при прохождении через золотую фольгу. (λе = λБ)
· 1949 г. Фабрикант, Биберман, Сушкин – экспериментально доказали, что волновые свойства присуще отдельным электронам, а не только электронам в пучке (дифракция электронов на щели).
(λе = λБ)
· 1927 г. Джозеф Томсон – наблюдал дифракцию потока электронов при прохождении через золотую фольгу. (λе = λБ)
· 1949 г. Фабрикант, Биберман, Сушкин – экспериментально доказали, что волновые свойства присуще отдельным электронам, а не только электронам в пучке (дифракция электронов на щели).
(λе = λБ)
|
Состояние электрона в атоме характеризуется четырьмя квантовыми числами:
|
Следствия из постулатов Бора:
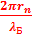 = n = n
 n – главное квантовое число, n = 1, 2, 3….
n – главное квантовое число, n = 1, 2, 3….
|
Теория вероятности для объяснения волновых свойств частиц.
|
|
|
|
|
|
|
Наиболее полно исследованы спектры излучения атома водорода
| Серия | Год открытия | Орбита, на которую переходит атом. n 1 | Орбита, с которой переходит атом. n 2 | Область излучения | Энергия излучения |
| Лаймана | 1916 | 1 | 2,3,4 … | У.Ф. | - 13,6 эВ |
| Бальмера | 1885 | 2 | 3,4,5… | видимая | - 3,39 эВ |
| Пашена | 1908 | 3 | 4,5, 6… | И.К. | -1,51 эВ |
| Брекет | 1922 | 4 | 5, 6, 7… | И.К. | - 0,85 эВ |
| Пфунд | 1924 | 5 | 6, 7… | И.К. | - 0,54 эВ |
Частоту и длину волны излучения атома водорода можно рассчитать по формулам:
ν = R ( 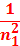 –
– 
 )
)  =
=  (
( 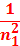 –
– 
 )
)
(R – постоянная Ридберга, R = 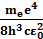 , R = 3, 29 * 1015 с – 1)
, R = 3, 29 * 1015 с – 1)
Атомы излучают:
|
| Спектры поглощения получаются, когда свет от источника проходит через какую – либо среду. |
| Спектры испускания получаются, когда свет идёт непосредственно от источника излучения. |
| С П Е К Т Р Ы |
(Таблица «Спектры испускания и поглощения»)
Сплошной спектр испускания
Линейчатый спектр испускания Na
Н
Полосатый спектр испускания
Линейчатый спектр поглощения
Na
|
|
|
H
|
|
|


