 |
Теория строения атома Бора- Зоммерфельда.
|
|
|
|
Теория строения атома Бора- Зоммерфельда.
Теория Бора была далее развита А. Зоммерфельдом, который доказал, что при отыскании стационарных состояний должны учитываться не только круговые, но и эллиптические орбиты, а также и и пространственная ориентация, которой орбиты могут приобретать в магнитном поле. Все это привело к введению в теорию новых квантовых чисел. Те же квантовые числа, что и в теории Бора - Зоммерфельда, но в другом толковании достаем при определении стационарных состояний в квантовой механике.
Для энергетических уровней ионов расчеты проведены с учетом эллиптичности орбит, как и расчеты, основанные на квантовой механике, дают формулу, которая совпадает по формуле:
где n - главное квантовое число, которое определяет размеры орбиты. От этого числа зависит главным образом энергия электрона в атоме. Оно может приобретать только целочисленных значений (n = 1, 2, 3,... ).
Согласно теории Бора, которая ограничивалась случаем круговых орбит, момент импульса L электрона в атоме определяется только главным квантовым числом:
В теории Бора - Зоммерфельда, которая учитывает возможность эллиптических орбит, момент импульса электрона также является величине, кратной h(2π ), т. е. элементарному момента импульса, но его значение определяется уже не главным квантовым числом л, а другим квантовым числом l, которое называют орбитальным, побочным, или азимутальной.
Квантовая механика. Основные положения квантовой механики: квантование энергии, корпускулярно- волновой характер движения микрочастиц, вероятностный метод описания микрообъектов. Уравнение Шредингера. Квантовые числа (главное, орбительное, магнитное, спиновое): определения, обозначения, значения. Принцип Паули. Правило Хунда. Правило Клечковского. Распределение электронов по квантовым ячейкам S, p, d элементы. Электронные провалы.
|
|
|
Квантовая механика- раздел физики изучающий движение и взаимодействие микрочастиц. В основу положено 3 положения: 1. Положение о квантовой энергии 2. О корпускулярно-волновом строении микрочастиц. 3. вероятностный метод описания микрочастиц.
Энергия поглощается, передается или испускается непрерывно, а определяется порциями квантали. Е=h*V(ню) Vчастота, -E- энергия, h-постоянная планка=6. 62*10^-34Дж/с. E=h*C/L(лямбда) С=V(ню)*L(лямбда)
2 положение: микрочастица с одной стороны имеют массу как частица, а сдругой обладают длиной волны. L=h/mē *oē
Уравнение Шредингера d^2 *Ψ /dx^2 +d^2Ψ /dy^2 +d^2Ψ /dz^2 +8∏ ^2mg/n^2 (E-V)=0
Ψ -волновая функция, Е-полная энергия.
Главное квантовое число n определяет основной запас энергии электрона, т. е. степень его удаления от ядра, или размер электронного облака (орбитали). Оно может принимать целочисленные значения от 1 до ∞.
Состояние электрона, характеризующееся определенным значением n, называется энергетическим уровнем электрона в атоме. Электроны, имеющие одинаковые значения n, образуют электронные слои (электронные оболочки), обозначаемые цифрами 1, 2, 3, 4, 5… или соответственно буквами: K, L, M, N, O…
Наименьшее значение энергии Е соответствует n=1. Остальным квантовым состояниям отвечают более высокие значения энергий, и электроны, находящиеся на этих энергетических уровнях, менее прочно связаны с ядром.
Орбитальное (побочное или азимутальное) квантовое числ оlопределяет орбитальный момент количества движения электрона l = 
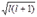 и характеризует форму электронного облака (рис. 34. 2). Оно принимает все целочисленные значения от 0 до (n-1). Каждому n соответствует определенное число значений орбитального квантового числа, т. е. энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Число подуровней, на которые расщепляется уровень, равно номеру уровня (т. е. численному значению n).
и характеризует форму электронного облака (рис. 34. 2). Оно принимает все целочисленные значения от 0 до (n-1). Каждому n соответствует определенное число значений орбитального квантового числа, т. е. энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Число подуровней, на которые расщепляется уровень, равно номеру уровня (т. е. численному значению n).
|
|
|
Энергетический подуровень - это состояние электрона в атоме, характеризующееся определенным набором квантовых чисел n, l. Такое состояние электрона, соответствующее определенным значениям n и l (т. е. тип орбитали), записывается в виде сочетания цифрового обозначения n и буквенного l, например: 4р (n=4; l=1); 5d (n =5; l =2).
Магнитное квантовое число ml определяет значение орбитального момента количества движения электрона L на произвольно выделенную ось z: Lz =  ml, т. е. характеризует пространственную ориентацию электронного облака.
Принцип Паули: В атомной или молекулярной системе не может быть двух электронов с одинаковым набором всех четырех квантовых чисел.
Правило Хунда: заполнение орбиталей подуровня идет таким образом чтобы сумма спин имело максимальное значение.
Правило клечковского: заполнение подуровня электронами идет в порядке увеличения суммы главного и орбитальных квантовых чисел. ∑ (n+l)
Электронные проавлы характерны для: Cu, Ag, Cr, Au, Nb, Ru, Rh, Pd. Электронные провалы связаны с более устойчивым состоянием полностью замещенного подуровня или наполовину.
|
|
|


