 |
Плазменные факторы свертывания крови
|
|
|
|
| № п/п | Название | Биохимический состав | Функция |
I Фибриноген Гликопротеид Основа тромба. Выпадение в осадок.
Выпавший в осадок фибриноген называется фибрин
II Протромбин» Неактивный фермент. Активная фор-
ма называется тромбин. Вызывает выпадение в осадок фибриногена. Одновременно растворяет фибрин
 Продолжение
Продолжение
| №п/п |
| Название |
| Функция |
Биохимический состав
| III Тканевой тромбо-пластин IV Кальций |
Фосфолипид Участвует в образовании тканевой протромбиназы
| Ионизированный кальций Глобулин |
Участвует во всех фазах свертывания крови
| V, VI Проакцелерин, акцелерин |
| Белок Глобулин |
Ускоряет свертывание крови. Неактивная и активная формы фермента вместе называются глобулин-акцеле-ратор
| VII Конвертин VIII Антигемофильный глобулин А IX Антигемофильный глобулин В (фактор Кристмаса) X Фактор Стюарта — Прауэра |
Фермент, участвует в образовании тканевой протромбиназы
Участвует в образовании кровяной протромбиназы
Участвует в образовании кровяной протромбиназы (активирует фактор X)
| XI Плазменный пред- Белок шественник тром-бопластина (фактор Розенталя) XII Фактор Хагемана Полипептид |
Участвует в образовании кровяной и тканевой протромбиназы, а также тромбина из протромбина Активирует фактор IX
Контактный фактор. Активирует фактор XI и совместно с ним инициирует процесс свертывания крови. Участвует в фибринолизе
| XIII Фибринстабилизи-рующий фактор |
Участвует в образовании фибрина, упрочняет связи между соседними молекулами. Участвует в регенерации тканей
Вещества, участвующие в свертывании крови, образуются постоянно и всегда присутствуют в крови, но в неактивном состоянии. При отсутствии хотя бы одного из факторов кровь теряет способность свертываться. Причин для этого существует много. Иногда это генетические заболевания (гемофилия), передающиеся по наследству. Кроме людей гемофилия встречается у лошадей, собак, свиней. Кровь не свертывается при уменьшении в плазме количества ионов кальция, при заболеваниях печени.
|
|
|
В биосинтезе многих факторов свертывания крови участвует витамин К (антигеморрагический витамин). Поэтому авитаминоз К сопровождается кровоизлияниями. В некоторых кормах может содержаться дикумарин — антагонист витамина К, поэтому отравление этим веществом также сопровождается несвертываемостью
крови. Дикумарин используют для борьбы с грызунами, вводя его в приманку. После поедания такой отравы крысы погибают от множественных внутренних кровоизлияний.
Свертывание крови протекает в три фазы с образованием соответственно протромбиназы, тромбина и фибрина.
Первая фаза. Протромбиназа — это комплекс веществ, обладающих ферментативной активностью. Образование протромбиназы может идти двумя путями — внутренним и внешним. Внутренняя активация факторов идет за счет веществ, присутствующих в плазме и в форменных элементах крови: фактор Хагемана (XII), фактор Розенталя (XI), антигемофильные глобулины А и В (VIII, IX), ионы кальция (IV), глобулин-акцелерин (VIII, VI).
Внутренняя система образования протромбиназы инициирует свертывание крови без внешнего повреждения стенок сосудов. Активатором в этом случае являются поврежденные мембраны тромбоцитов: тромбоциты после адгезии и агрегации на измененной сосудистой стенке разрушаются. Активный ферментный комплекс, образующийся за счет факторов, находящихся внутри сосуда, называется кровяной протромбиназой. Он образуется в течение 5... 10 мин.
Процесс начинается с активации фактора Хагемана (XII) и подобно цепной реакции охватывает другие факторы. Фактор Хагемана называют контактным фактором, так как после активации он не уносится потоком крови, а остается на поврежденной поверхности.
|
|
|
Внешний путь активации ферментов начинается с повреждения сосудов, когда из разрушенных эпителиальных клеток выделяется тканевой тромбопластин (III). Он взаимодействует с белком проконвертином (VII), глобулином-акцелерином (V, VI), фактором Стюарта — Прауэра (X) и ионами кальция. При этом активаторами являются элементы разрушенных стенок кровеносного сосуда — коллагеновые волокна, фосфолипиды мембран и др. Образовавшийся ферментный комплекс называется тканевой протромбиназой. Он образуется быстрее, чем кровяная протромбиназа, — за 5...10 с.
Итак, первая фаза свертывания крови заканчивается образованием протромбиназы — активного ферментного комплекса.
Вторая фаза свертывания крови заключается в том, что под влиянием протромбиназы и в присутствии ряда плазменных факторов (ионы кальция, проконвертин, фактор Стюарта — Прауэра) происходит активация нового участника гемокоагуляции — протромбина. Протромбин — неактивный фермент, под воздействием протромбиназы переходит в активную форму — тромбин. Этот процесс происходит всего за 1...5 с.
Обнаружено, что небольшое количество протромбина постоянно активируется и превращается в тромбин, но в нормальных условиях концентрация тромбина недостаточна для того, чтобы вызвать свертывание крови.
 Протромбин синтезируется в печени и находится в крови в довольно высокой концентрации. В 10 мл крови его содержится такое количество, которого достаточно, чтобы свернулась вся кровь в организме — вот такой «резерв». Однако накопления его в крови не происходит: причины этого будут рассмотрены дальше.
Протромбин синтезируется в печени и находится в крови в довольно высокой концентрации. В 10 мл крови его содержится такое количество, которого достаточно, чтобы свернулась вся кровь в организме — вот такой «резерв». Однако накопления его в крови не происходит: причины этого будут рассмотрены дальше.
Третья фаза свертывания крови происходит при участии тромбина. Активный тромбин вызывает выпадение в осадок фибриногена — белка, постоянно находящегося в плазме крови.
Как и протромбин, фибриноген непрерывно синтезируется в печени и поступает в кровь; его концентрация в среднем составляет 2...4 г/л. Часть фибриногена из крови через стенки капилляров выходит в межклеточную жидкость и по лимфатическим сосудам возвращается в кровь, поэтому лимфа, как и кровь, обладает способностью свертываться. В сосудистом эпителии какое-то количество фибриногена распадается до полипептидов и аминокислот.
|
|
|
Поскольку в организме постоянно образуется некоторое количество тромбина, то небольшая часть фибриногена может перейти в нерастворимое состояние — фибрин. Отметим, что это происходит не в случае свертывания крови, а в обычных условиях. Образующийся фибрин покрывает нежным тонким слоем внутреннюю поверхность кровеносных сосудов, а также все узкие каналы организма — слезные протоки, молочные канальцы, желчевыводящие пути, семенной канатик и др. Слой фибрина улучшает проницаемость капилляров. Кроме того, фибрин адсорбирует излишки тромбина и других факторов свертывания, препятствуя свертыванию крови.
Фибрин вначале появляется в виде нежных тонких беловатых волокон (нитей). В петлях волокон застревают форменные элементы крови, поэтому сгусток крови приобретает из-за эритроцитов красный цвет. Затем нити фибрина уплотняются, из фибрина-мономера образуется фибрин-полимер, сгусток крови становится более плотным и прочным.
Образование фибринового тромба заканчивает третью фазу свертывания крови, и далее начинается послефаза, или, как чаще говорят, третий этап гемостаза.
Третий этап гемостаза включает два процесса — ретракцию кровяного сгустка и его растворение — фибринолиз.
Ретракция, или сокращение и уплотнение фибринового тромба, сопровождается выделением из него сыворотки крови — прозрачной жидкости желтого цвета. По составу сыворотка подобна плазме, но в ней нет фибриногена и ряда других факторов свертывания крови, поэтому она не может свертываться. В ретракции кровяного сгустка участвуют ферменты тромбоцитов (например, тромбостенин).
Биологическое значение ретракции сгустка крови заключается в том, что сгусток становится, во-первых, более прочным и непро-
ницаемым для крови, а во-вторых, он стягивает края поврежденного сосуда, способствуя регенерации.
|
|
|
Фибринолиз — это процесс ферментативного растворения фибрина. Распадается до аминокислот фибрин, отложившийся в естественных условиях на внутренней поверхности сосудов, в межклеточном пространстве, в каналах и мелких протоках органов, а также составляющий основу кровяного сгустка. В результате фибринолиза происходит рассасывание мелких тромбов, а в более крупных тромбах — образование каналов, по которым может восстановиться движение крови; это явление называется канализацией тромба.
Фермент, растворяющий фибрин, называется плазмином. У здорового животного в крови находится его неактивная форма — плазминоген. Плазминоген синтезируется в печени, костном мозге, в почках. Наиболее низкая концентрация его в крови плодов и новорожденных. При беременности уровень плазминогена в крови повышается.
В организме существует большое количество веществ, являющихся активаторами плазминогена, под их воздействием плазминоген превращается в плазмин. Одним из активаторов является фактор Хагемана, играющий ключевую роль в свертывании крови. Выработка активаторов плазминогена усиливается под влиянием различных стимулов — адреналина, никотиновой кислоты, при физических и психических нагрузках, то есть в тех случаях, когда повышается свертываемость крови. Активаторы плазминогена обычно адсорбируются, как и сам плазминоген, в слое фибрина, покрывающего интиму сосудов.
Кроме активаторов в крови имеются и ингибиторы, или анти-плазмины, — вещества, блокирующие или разрушающие плазмин, а также антиактиваторы плазминогена — вещества, тормозящие активацию плазминогена. В совокупности плазминоген вместе со своими активаторами и ингибиторами составляет фибринолитичес-кую систему крови.
Таким образом, мы рассмотрели основные механизмы гемостаза — механизмы, благодаря которым кровь находится в кровеносных сосудах в жидком состоянии, в случае необходимости может свертываться и затем за счет фибринолиза вызывать восстановление кровотока.
Почему кровь не свертывается в кровеносных сосудах? Причин несколько.
1. Вещества, участвующие в свертывании крови, находятся в неактивном состоянии. Хотя небольшое количество фибрина в естественных условиях и образуется, но фибринолитическая система уравновешивает этот процесс и препятствует превышению его физиологического порога в крови.
2. Внутренняя поверхность кровеносных сосудов гладкая, имеет отрицательный электрический заряд, как и форменные элемен-
 ты крови. Поэтому тромбоциты не прилипают к стенкам сосудов и не разрушаются. Постоянное движение крови приводит к тому, что форменные элементы распределяются ближе к оси сосудов, а вдоль стенок струится плазма крови — это тоже предохраняет тромбоциты от разрушения. При резком замедлении или остановке движения крови вероятность ее свертывания повышается.
ты крови. Поэтому тромбоциты не прилипают к стенкам сосудов и не разрушаются. Постоянное движение крови приводит к тому, что форменные элементы распределяются ближе к оси сосудов, а вдоль стенок струится плазма крови — это тоже предохраняет тромбоциты от разрушения. При резком замедлении или остановке движения крови вероятность ее свертывания повышается.
|
|
|
3. Клетки кровеносных сосудов продуцируют тканевые гормоны — простагландины. Простагландины препятствуют агрегации тромбоцитов, а если тромбоцитарная пробка уже образовалась, то простагландины ограничивают ее распространение на другие участки сосуда.
4. В крови присутствуют естественные антикоагулянты, то есть вещества, препятствующие свертыванию крови. Одни из них — ан-титромбопластины — задерживают образование протромбиназы, другие — антитромбины — блокируют образование тромбина.
Примером таких веществ служит гепарин, который тормозит свертывание крови во всех трех фазах, то есть обладает широким спектром действия. Гепарин синтезируется в базофилах крови и в тучных клетках, находящихся в различных тканях. Много гепарина содержится в печени (это объясняет его название), в легких, в селезенке. В крови его уровень в 2—4 раза больше, чем необходимо, то есть имеется его резерв. Вспомним, что и протромбина — предшественника тромбина — в крови тоже избыток.
Фармакологический препарат гепарина получают либо из печени животных (на мясокомбинатах), либо синтетическим путем. В медицине и ветеринарии его используют для хранения жидкой крови (чтобы она не свернулась в пробирке), при катетеризации кровеносных сосудов. Гепарин применяют также для лечения целой группы заболеваний, сопровождающихся кровоточивостью и повышенной способностью крови к свертыванию, для профилактики внутрисосудистого тромбообразования и рассасывания свежих рыхлых сгустков крови.
Регуляция свертывания крови. Как уже было сказано, время свертывания крови является видовым признаком животных. Однако в ряде случаев это время изменяется. Если время свертывания крови увеличивается — говорят о замедлении свертывания, если укорачивается — об ускорении.
Давно известно, что у доноров, а также у людей перед операцией время свертывания крови уменьшается с 8... 10 до З...4мин. Сходная реакция отмечена у студентов перед сдачей трудного экзамена. У животных при болевых раздражениях, как и у людей, также возрастает свертывающая способность крови. Поскольку во всех этих случаях повышается активность симпатической нервной системы и увеличивается выброс в кровь адреналина, то ранее полагали, что симпатический отдел нервной системы ускоряет свертываемость крови.
Однако затем оказалось, что ускорение свертывания крови происходит и при возбуждении парасимпатической нервной системы, и при введении в кровь ацетилхолина. Это позволило сделать заключение о том, что в процессе эволюции выработалась одна реакция на все воздействия — ускорение свертывания крови. Эта реакция имеет защитно-приспособительный характер, она подготавливает организм к более быстрому образованию сгустка крови при угрозе травмы.
При действии на организм любых чрезвычайных раздражителей происходит рефлекторный выброс в кровь из стенок кровеносных сосудов большого количества факторов свертывания и повышается содержание тромбина.
Большую роль в ускорении свертывания крови играет адреналин. При повышении содержания адреналина в крови из стенок кровеносных сосудов выделяется тромбопластин, который быстро превращается в кровяную протромбиназу. Адреналин также освобождает фосфолипиды из форменных элементов крови, активирует фактор Хагемана. Активация адреналином тканевых липаз приводит к расщеплению жиров и поступлению в кровь жирных кислот, обладающих тромбопластической активностью.
Важно отметить, что у здоровых людей и животных при всех случаях ускорения свертывания крови одновременно увеличивается активность фибринолитической системы, что предупреждает коагуляцию и образование тромбов, когда в этом нет необходимости, и способствует растворению уже образовавшегося фибрина.
Через некоторое время после ускорения свертывания крови наступает замедление. Это проявляется в удлинении времени образования сгустка крови. Считается, что уменьшение свертываемости крови является вторичным явлением, оно обусловлено израсходованием факторов свертывающей системы крови. Например, во время продолжительных родов или операций есть реальная угроза полной потери коагулирующих свойств крови.
Таким образом, в организме в диалектическом единстве существуют как свертывающие, так и противосвертывающие механизмы. К свертывающим механизмам относят все факторы, принимающие участие в свертывании крови, — плазменные, тромбоцитар-ные, сосудистые и др.
Противосвертывающая система включает две системы:
всегда находящиеся в крови естественные антикоагулянты — антитромбопластины, антитромбины, плазминоген и другие вещества, взаимодействующие с постоянно образующимся тромбином;
рефлекторная, включающаяся при образовании большого количества тромбина. В кровеносных сосудах имеются рецепторы, чувствительные к повышенному уровню тромбина. Возбуждение этих рецепторов приводит к выделению в кровь антикоагулянтов и активаторов фибринолитической системы.
8 — 3389
В здоровом организме в условиях физиологического покоя мощность свертывающей и противосвертывающей систем уравновешена таким образом, что кровь остается жидкой, но в чрезвычайных ситуациях активность обеих систем возрастает и равновесие устанавливается на новом уровне. Регулирует эти процессы ЦНС и ее ведущий отдел — кора больших полушарий головного мозга.
ФОРМЕННЫЕ ЭЛЕМЕНТЫ КРОВИ
К форменным элементам, или клеткам, крови относятся три класса: эритроциты, лейкоциты и тромбоциты.
Эритроциты. Морфология эритроцитов. Зрелые эритроциты у рептилий, амфибий, рыб и птиц имеют ядра. Эритроциты млекопитающих — безъядерные: ядра исчезают на ранней стадии развития в костном мозге. Эритроциты могут быть в форме двояковогнутого диска, круглые или овальные (овальные у лам и верблюдов) (рис. 3.2.) Каждый эритроцит желтовато-зеленого цвета, но в толстом слое эритроцитарная масса красного цвета (лат. erythros — красный). Красный цвет крови обусловлен наличием в эритроцитах гемоглобина.
Образуются эритроциты в красном костном мозге. Средняя продолжительность их существования составляет около 120 сут;
|
разрушаются они в селезенке и в печени, лишь небольшая их часть подвергается фагоцитозу в сосудистом русле.
Эритроциты, находящиеся в кровяном русле, неоднородны. Они различаются по возрасту, форме, размеру, устойчивости к неблагоприятным воздействиям. В периферической крови одновременно находятся молодые, зрелые и старые эритроциты. Молодые эритроциты в цитоплазме имеют включения — остатки ядерной субстанции и называются ретикулоцитами. В норме ретикулоциты составляют не более 1 % от всех эритроцитов, повышенное их содержание указывает на усиление эритропоэза.
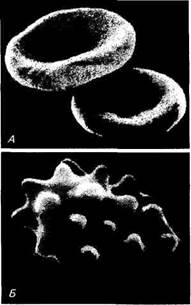
Рис. 3.2. Форма эритроцитов:
А — двояковогнутый диск (норма); Б — сморщенный в гипертоническом солевом растворе
Двояковогнутая форма эритроцитов обеспечивает большую площадь поверхности, поэтому общая поверхность эритроцитов в Ц5—2 тысячи раз превышает поверхность тела животного. Часть эритроцитов имеет шарообразную форму с выступами (шипи-ками), такие эритроциты называются эхиноцитами. Некоторые эритроциты — куполообразной формы — стомациты.
Диаметр эритроцитов у разных видов животных различен. Очень крупные эритроциты у лягушек (до 23мкм) и у кур (12мкм). Среди млекопитающих самые маленькие эритроциты — 4 мкм — имеют овцы и козы, а самые большие — свиньи и лошади (6...8 мкм). У животных одного вида в основном размеры эритроцитов одинаковы, и только небольшая часть имеет колебания в пределах 0,5... 1,5 мкм.
Мембрана эритроцитов, как и у всех клеток, состоит из двух молекулярных липидных слоев, в которые встроены белковые молекулы. Одни молекулы образуют ионные каналы для транспорта веществ, а другие являются рецепторами (например, хо-линорецепторы) или имеют антигенные свойства (например, агглютиногены). В мембране эритроцитов высокий уровень хо-линэстеразы, что предохраняет их от плазменного (внесинапти-ческого) ацетилхолина.
Через полупроницаемую мембрану эритроцитов хорошо проходят кислород и углекислый газ, вода, ионы хлора, бикарбонаты. Ионы калия и натрия проникают через мембрану медленно, а для ионов кальция, белковых и липидных молекул мембрана непроницаема. Ионный состав эритроцитов отличается от состава плазмы крови: внутри эритроцитов поддерживается более высокая концентрация калия и меньшая натрия, чем в плазме крови. Градиент концентрации указанных ионов сохраняется за счет работы натрий-калиевого насоса.
Гемоглобин — дыхательный пигмент, составляет до 95 % сухого остатка эритроцитов. В цитоплазме эритроцитов имеются нити актина и миозина, формирующие цитоскелет и ряд ферментов.
Оболочка эритроцитов эластична, поэтому они способны проходить через мелкие капилляры, диаметр которых в некоторых органах меньше диаметра эритроцитов.
При повреждении оболочки из эритроцитов в плазму крови выходит гемоглобин и другие компоненты цитоплазмы. Такое явление называется гемолизом. У здоровых животных в плазме разрушается очень небольшое количество старых эритроцитов, это — физиологический гемолиз. Причины более значительного гемолиза как in vivo, так и in vitro могут быть различными.
Осмотический гемолиз наступает при снижении осмотического давления плазмы крови. В таком случае вода проникает внутрь эритроцитов, эритроциты увеличиваются в размерах и разрываются. Устойчивость эритроцитов к гипотоническим растворам называется осмотической резистентностью. Ее можно определить, по-
8*

 мещая эритроциты, отмытые от плазмы крови, в растворы хлорида натрия разной концентрации — от 0,9 до 0,1 %. Обычно гемолиз начинается при концентрации хлорида натрия 0,5...0,7 %; полностью все эритроциты разрушаются при концентрации 0,3...0,4 %. Границы концентрации, при которых начинается и заканчивается гемолиз, называют шириной резистентности эритроцитов. Следовательно, не все эритроциты обладают одинаковой устойчивостью к гипотоническим растворам.
мещая эритроциты, отмытые от плазмы крови, в растворы хлорида натрия разной концентрации — от 0,9 до 0,1 %. Обычно гемолиз начинается при концентрации хлорида натрия 0,5...0,7 %; полностью все эритроциты разрушаются при концентрации 0,3...0,4 %. Границы концентрации, при которых начинается и заканчивается гемолиз, называют шириной резистентности эритроцитов. Следовательно, не все эритроциты обладают одинаковой устойчивостью к гипотоническим растворам.
Осмотическая резистентность эритроцитов зависит от проницаемости их мембраны для воды, что связано с ее строением и возрастом эритроцитов. Повышение устойчивости эритроцитов, когда они вьщерживают более низкую концентрацию соли, указывает на «старение» крови и задержку эритропоэза, а понижение резистентности — на «омоложение» крови, усиление кроветворения.
Механический гемолиз возможен при взятии крови (в пробирке): при насасывании из вены через узкие иглы, при грубом встряхивании и перемешивании. При заборе крови из вены струя крови из иглы должна стекать по стенке пробирки, а не ударяться о дно.
Термический гемолиз происходит при резком изменении температуры крови: например, при взятии крови у животного в зимнее время в холодную пробирку, при замораживании. При замораживании вода в клетках крови превращается в лед и кристаллы льда, увеличиваясь в объеме, разрушают оболочку. Термический гемолиз наступает также при нагревании крови выше 50...55 °С вследствие коагуляции белков в мембранах.
Химический гемолиз обычно наблюдается вне организма, при попадании в кровь кислот, щелочей, органических растворителей — спиртов, эфира, бензола, ацетона и др.
Биологический, или токсический, гемолиз может произойти прижизненно, при попадании в кровь различных гемолитических ядов (например, при змеиных укусах, при некоторых отравлениях). Биологический гемолиз возникает при переливании несовместимой группы крови.
Гемоглобин и его формы. Гемоглобин представляет собой соединение четырех молекул гема (небелковая пигментная группа) с глобином (простетическая группа). Гем содержит двухвалентное железо. Гем у животных всех видов одинакового состава, а глобины отличаются своим аминокислотным составом. Кристаллы гемоглобина имеют видовые особенности, что используется для идентификации крови или ее следов в судебной ветеринарии и медицине.
Гемоглобин связывает кислород и диоксид углерода и легко их отщепляет, благодаря чему осуществляет дыхательную функцию. Синтез гемоглобина происходит в красном костном мозге эри-тробластами и в течение существования эритроцитов не обменивается. При разрушении старых эритроцитов гемоглобин превра-
щается в желчные пигменты — билирубин и биливердин. В печени эти пигменты переходят в состав желчи и удаляются из организма через кишечник. Основная часть железа из разрушенного гема снова расходуется на синтез гемоглобина, а меньшая часть удаляется из организма, поэтому организму постоянно необходимо поступление железа с пищей.
Различают несколько форм гемоглобина (НЬ). Примитивный и фетальный гемоглобин — соответственно у зародыша и плода. Эти формы гемоглобина насыщаются при меньшем содержании кислорода в крови, чем у взрослых животных. В течение первого года жизни у сельскохозяйственных животных фетальный гемоглобин (HbF) замещается полностью на гемоглобин, свойственный взрослым, — НЬА.
Оксигемоглобин (НЬ02) — соединение гемоглобина с кислородом. Восстановленный, или редуцированный, — это гемоглобин, отдавший кислород.
Карбогемоглобин (НЬС02) — гемоглобин, присоединивший диоксид углерода. НЬ02 и НЬС02 — соединения непрочные, они легко отдают присоединившиеся молекулы газов.
Карбоксигемоглобин (НЬСО) — соединение гемоглобина с угарным газом (СО). Гемоглобин значительно быстрее соединяется с угарным газом, чем с кислородом. Даже небольшая примесь угарного газа в воздухе — всего 0,1 % — блокирует около 80 % гемоглобина, т. е. он уже не может присоединить кислород и выполнить свою дыхательную функцию. НЬСО нестоек, и если пострадавшему вовремя обеспечить доступ свежего воздуха, то гемоглобин быстро освобождается от угарного газа.
Миоглобш — тоже соединение кислорода с гемоглобином, но это вещество находится не в крови, а в мышцах. Миоглобин участвует в обеспечении кислородом мышц в условиях недостаточности его в крови (например, у ныряющих животных).
Во всех перечисленных формах гемоглобина валентность железа не меняется. Если же под воздействием каких-либо сильных окислителей железо в геме становится трехвалентным, то такая форма гемоглобина называется метгемоглобин. Метгемоглобин не может присоединять кислород. В физиологических условиях концентрация метгемоглобина в крови небольшая — всего 1...2% от всего гемоглобина, причем он находится в основном в старых эритроцитах. Считают, что причиной физиологической метгемо-глобинемии является окисление железа в геме за счет активных ионизированных молекул кислорода, поступающих в эритроцит, хотя в эритроцитах имеется фермент, поддерживающий двухвалентную форму железа.
Предполагают, что в физиологических условиях метгемоглобин обезвреживает ядовитые вещества — токсины, образующиеся в организме в процессе обмена веществ или поступающие извне: цианиды, фенол, сернистый водород, янтарная и масляная кислоты и др.

 Если же значительная часть гемоглобина крови перейдет в метгемо-глобин, то возникнет кислородная недостаточность тканей. Такое состояние может быть при отравлении нитратами и нитритами.
Если же значительная часть гемоглобина крови перейдет в метгемо-глобин, то возникнет кислородная недостаточность тканей. Такое состояние может быть при отравлении нитратами и нитритами.
Количество гемоглобина в крови является важным клиническим показателем дыхательной функции крови. Оно измеряется в граммах на литр крови (г/л). У лошади уровень гемоглобина в среднем 90...150 г/л, у крупного рогатого скота — 100...130, у свиней - 100...120 г/л.
Другой важный показатель — это количество эритроцитов в крови. В среднем у крупного рогатого скота в 1 л крови содержится (5...7) • 1012 эритроцитов. Коэффициент 1012 называется «тера», и общий вид записи следующий: 5...7 Т/л (читается: тера на литр). У свиней в крови содержится 5...8 Т/л эритроцитов, у коз до 14 Т/л. У коз большое количество эритроцитов обусловлено тем, что они очень маленького размера, поэтому объем всех эритроцитов у коз такой же, как у других животных.
Содержание эритроцитов в крови у лошадей зависит от их породы и хозяйственного использования: у лошадей шаговых пород — 6...8 Т/л, у рысистых — 8...10, а у верховых — до 11 Т/л. Чем больше потребность организма в кислороде и питательных веществах, тем больше эритроцитов содержится в крови. У высокопродуктивных молочных коров уровень эритроцитов соответствует верхней границе нормы, у низкомолочных — нижней.
У новорожденных животных количество эритроцитов в крови всегда больше, чем у взрослых. Так, у телят 1...6-месячного возраста содержание эритроцитов доходит до 8... 10 Т/л и стабилизируется на уровне, свойственном взрослым животным, к 5...6 годам. У самцов в крови содержится больше эритроцитов, чем у самок.
Функции эритроцитов:
1. Перенос кислорода от легких к тканям и диоксида углерода от тканей к легким.
2. Поддержание рН крови (гемоглобин и оксигемоглобин составляют одну из буферных систем крови).
3. Поддержание ионного гомеостаза за счет обмена ионами между плазмой и эритроцитами.
4. Участие в водном и солевом обмене.
5. Адсорбция токсинов, в том числе продуктов распада белка, что уменьшает их концентрацию в плазме крови и препятствует переходу в ткани.
6. Участие в ферментативных процессах, в транспорте питательных веществ — глюкозы, аминокислот.
Уровень содержания эритроцитов в крови изменяется. Уменьшение количества эритроцитов ниже нормы (эозинопения) у взрослых животных обычно наблюдается только при заболеваниях, а повышение сверх нормы возможно и при заболеваниях, и у здоровых животных. Увеличение содержания эритроцитов в крови у здоровых животных называется физиологическим эритроцито-
зом. Различают три формы физиологических эритроцитозов: перераспределительный, истинный и относительный.
Перераспределительный эритроцитов возникает быстро и является механизмом срочной мобилизации эритроцитов при внезапной нагрузке — физической или эмоциональной. При нагрузке возникает кислородное голодание тканей, в крови накапливаются не-доокисленные продукты обмена. Раздражаются хеморецепторы сосудов, возбуждение передается в ЦНС. Ответная реакция осуществляется при участии симпатической нервной системы. Происходит выброс крови из кровяных депо и синусов костного мозга. Таким образом, механизмы перераспределительного эритроцитоза направлены на перераспределение имеющегося запаса эритроцитов между депо и циркулирующей кровью. После прекращения нагрузки содержание эритроцитов в крови восстанавливается.
Истинный эритроцитоз характеризуется увеличением активности костномозгового кроветворения. Для развития истинного эритроцитоза требуется более длительное время, а регуляторные процессы оказываются более сложными. Индуцируется длительной кислородной недостаточностью тканей с образованием в почках низкомолекулярного белка — эритропоэтина, который и активизирует эритропоэз. Истинный эритроцитоз обычно развивается при систематических мышечных тренировках, длительном содержании животных в условиях пониженного атмосферного давления. К этому же типу относится эритроцитоз у новорожденных животных.
Рассмотрим на конкретном примере, как смена условий содержания животных приводит к развитию у них физиологического эритроцитоза. В южных районах России практикуют отгонное животноводство. Летом скот начинают перегонять на высокогорные пастбища, где не жарко, хороший травостой, нет кровососущих насекомых. Вначале, когда скот поднимается по дорогам вверх, в горы, для обеспечения увеличенной потребности в кислороде происходит перераспределение эритроцитов между кровяными депо и циркулирующей кровью (перераспределительный эритроцитоз). По мере поднятия в горы к физической нагрузке добавляется еще один мощный фактор воздействия — разрежение воздуха, т. е. понижение атмосферного давления и содержания кислорода в воздухе. Постепенно, в течение нескольких дней костный мозг перестраивается на новый, более интенсивный уровень кроветворения, и перераспределительный эритроцитоз сменяется истинным. Истинный эритроцитоз сохраняется в течение длительного времени после возвращения животных осенью в равнинные места, что повышает резистентность организма к неблагоприятным природно-климатическим условиям.
Относительный эритроцитоз не связан ни с перераспределением крови, ни с выработкой новых эритроцитов. Относительный эритроцитоз наблюдается при обезвоживании животного, вследствие чего возрастает гематокрит, т. е. содержание эритроцитов в
единице объема крови увеличивается, а плазмы — уменьшается. После обильного поения или введения в кровь физиологического раствора гематокритная величина восстанавливается.
Реакция оседания эритроцитов. Если взять кровь у животного, добавить в нее антикоагулянт и дать отстояться, то через некоторое время можно наблюдать оседание эритроцитов, а в верхней части сосуда будет находиться слой плазмы крови.
Скорость оседания эритроцитов (СОЭ) учитывают по отстоявшемуся столбику плазмы в миллиметрах за час или 24 ч. По методу Панченкова СОЭ определяют в капиллярных трубках, закрепленных в штативе вертикально. У животных СОЭ видоспецифична: быстрее всего оседают эритроциты у лошади (40...70 мм/ч), медленнее всего — у жвачных (0,5...1,5 мм/ч и 10...20 мм/24 ч); у свиней — в среднем 6... 10 мм/ч, а у птиц 2...4 мм/ч.
Основная причина оседания эритроцитов заключается в их склеивании, или агглютинации. Поскольку плотность эритроцитов больше, чем плазмы крови, то образовавшиеся комочки из склеившихся эритроцитов оседают. Эритроциты, находящиеся в кровяном русле и движущиеся с током крови, имеют одинаковые электрические заряды и отталкиваются друг от друга. В крови, находящейся вне организма («в стекле»), эритроциты теряют свои заряды и начинают образовывать так называемые монетные столбики. Такие агрегаты становятся более тяжелыми и оседают.
Эритроциты лошади в отличие от других видов животных имеют на мембранах агглютиногены, которые, вероятно, и вызывают ускоренную агглютинацию, поэтому все эритроциты у лошади оседают в первый час реакции.
Что влияет на скорость оседания эритроцитов?
1. Количество эритроцитов в крови и их заряд. Чем больше эритроцитов в крови, тем медленнее они оседают. Напротив, при всех случаях анемии (уменьшения содержания эритроцитов) СОЭ возрастает.
2. Вязкость крови. Чем больше вязкость крови, тем медленнее оседают эритроциты.
3. Реакция крови. При ацидозах СОЭ уменьшается. Это явление может быть хорошим тестом для выбора оптимального режима тренировки для спортивной лошади. Если после нагрузки СОЭ значительно снижается, то это может быть связано с накоплением в крови недоокисленных продуктов (метаболический ацидоз). Следовательно, такой лошади надо уменьшить нагрузку.
4. Белковый спектр плазмы крови. При увеличении в крови глобулинов и фибриногена СОЭ ускоряется. Причиной ускорения оседания эритроцитов является адсорбция упомянутых белков на поверхности эритроцитов, нейтрализация их зарядов и утяжеление клеток. Поэтому СОЭ увеличивается при беременности (перед родами), а также при инфекционных болезнях и воспалительных процессах.
СОЭ является важным клиническим показателем состояния животного. При заболеваниях СОЭ может замедляться, ускоряться или оставаться в пределах нормы, что важно в дифференциальной диагностике. Однако надо иметь в виду, что и у здоровых животных возможны колебания СОЭ, поэтому следует оценивать совокупность и лабораторных, и клинических показателей.
Лейкоциты. Количество лейкоцитов. У здоровых лошадей, крупного и мелкого рогатого скота в крови содержится 6... 10 Г/л лейкоцитов (Г = 109; читают: гига на литр); у свиней лейкоцитов больше —8...16, а у птиц — 20...40 Г/л. Уменьшение количества лейкоцитов в крови называется лейкопенией. В последние десятилетия наметилась тенденция к снижению числа лейкоцитов в крови у здоровых животных и людей до 4 Г/л. Считают, что небольшая лейкопения связана с нарушениями экологии и не всегда является патологией.
Увеличение количества лейкоцитов называется лейкоцитозом. Лейкоцитозы подразделяют на физиологические, патологические и медикаментозные. У здоровых животных лейкоцитоз может быть в следующих случаях.
1. Лейкоцитоз беременных — в последнюю стадию беременности.
2. Лейкоцитоз новорожденных.
3. Алиментарный лейкоцитоз, то есть связанный с приемом корма. Обычно бывает у животных с однокамерным желудком через 2...4 ч после кормления, во время интенсивного всасывания веществ из кишечника.
4. Миогенный лейкоцитоз. Возникает у лошадей после напряженной физической нагрузки. Чем тяжелее и изнурительнее была работа, тем выше лейкоцитоз; в крови появляются перерожденные, дегенеративные клетки. Так, у лошадей после очень интенсивной нагрузки отмечали до 50 Г/л лейкоцитов, что в 5... 10 раз больше нормы.
5. Эмоциональный лейкоцитоз. Проявляется при сильных эмоциональных перегрузках, при болевых раздражениях. Например, лейкоцитоз у студентов при сдаче трудного экзамена.
6. Условно-рефлекторный лейкоцитоз. Вырабатывается, если индифферентный раздражитель неоднократно сочетать с безусловным, вызывающим лейкоцитоз. Например, если одновременно с нанесением болевого раздражения включать звонок, то после нескольких опытов уже один звонок вызывает лейкоцитоз.
По механизму развития физиологические лейкоцитозы могут быть двух типов: перераспределительные и истинные. Как и эри-троцитозы, перераспределительные лейкоцитозы являются временными за счет перехода лейкоцитов из кровяных депо или пассивного вымывания из кроветворных органов. Истинные лейкоцитозы возникают при более интенсивном кроветворении, они развиваются медленно, но сохраняются в течение длительного времени. Относительных лейкоцитозов, по аналогии с относительным эри-
 троцитозом, не бывает, так как общее количество лейкоцитов в крови намного меньше, чем эритроцитов. Поэтому при сгущении крови увеличение гематокрита происходит за счет эритроцитов, а не лейкоцитов.
троцитозом, не бывает, так как общее количество лейкоцитов в крови намного меньше, чем эритроцитов. Поэтому при сгущении крови увеличение гематокрита происходит за счет эритроцитов, а не лейкоцитов.
Функции лейкоцитов. В крови присутствуют две группы лейкоцитов: зернистые, или гранулоциты (содержат в цитоплазме зернистость, видимую при фиксации и окраске мазка), и незернистые, или агранулоциты (зернистость в цитоплазме отсутствует). К зернистым лейкоцитам относятся базофилы, эозинофилы и нейтрофилы. Незернистые лейкоциты — лимфоциты и моноциты.
Все гранулоциты образуются в красном костном мозге. Их количество в синусах костного мозга больше, чем в крови, примерно в 20 раз, они и являются резервом для перераспределительного лейкоцитоза. При полной остановке развития лейкоцитов костный мозг способен в течение 6 сут поддерживать нормальный уровень их в крови.
Лейкоциты задерживаются в костном мозге в зрелом состоянии до 3 сут, после чего попадают в кровоток. Однако через несколько дней гранулоциты навсегда покидают сосудистое русло и мигрируют в ткани, где продолжают осуществлять свои функции и впоследствии разрушаются. Они удаляются из организма и другим путем, слущиваясь со слизистых оболочек верхних дыхательных путей, желудочно-кишечного тракта и мочеполовых путей. Продолжительность жизни гранулоцитов — от нескольких часов до 4...6 сут.
Базофилы. Базофилы синтезируют в гранулах и выделяют в кровь гистамин и гепарин. Гепарин является основным антикоагулянтом, он препятствует свертыванию крови в сосудах. Гистамин — антагонист гепарина. Кроме того, гистамин выполняет ряд других функций: он стимулирует фагоцитоз, увеличивает проницаемость кровеносных сосудов, расширяет артериолы, капилляры и венулы. Базофилы синтезируют также и другие БАВ — хе-мотоксические факторы, привлекающие эозинофилы и нейтрофилы, простагландины, некоторые факторы свертывания крови. В крови содержание базофилов очень незначительное — до 1 % по отношению ко всем лейкоцитам.
Близкими по своим морфологическим и физиологическим свойствам являются тучные клетки. Они находятся не в крови, хотя в небольшом количестве могут в ней присутствовать, а в соединительнотканных пространствах. Большей частью они встречаются вокруг кровеносных сосудов, главным образом в коже, по всему дыхательному и пищеварительному тракту, то есть в местах контакта внутренней среды организма с внешней. Уже само расположение тучных клеток наводит на мысль о том, что они участвуют в защитных реакциях организма от вредоносных факторов внешней среды. Скопление тучных клеток обнаруживается также там, где появился чужеродный белок.
Происхождение тучных клеток пока не выяснено. Вероятно, они образуются в костном мозге и могут мигрировать из крови в соединительнотканные пространства. Установлено, что тучные клетки могут размножаться.
Механизмы дегрануляции базофилов и тучных клеток, очевидно, одинаковы и зависят от функционального состояния этих клеток. В состоянии покоя клеток происходит медленный экзоцитоз (выделение) везикул, содержащих БАВ. При усиленном функционировании, действии на клетку различных агрессивных факторов мелкие гранулы (везикулы) объединяются, образуются «каналы» между гранулой и внеклеточной средой, или же гранулы сливаются с наружной мембраной клетки, последняя разрывается, при этом клетка иногда полностью разрушается. В любом случае на грануляцию базофилов и тучных клеток идет внутриклеточный запас кальция, а для перемещения, или транслокации, гранул используются сократительные микрофиламентные структуры клеток.
Активация базофилов стимулируется иммунным комплексом антиген—иммуноглобулин Е и другими веществами — компонентами системы комплемента, полисахаридами бактерий, антигенами плесневых грибов, аллергенами домашней пыли и др.
Эозинофилы. Эозинофилы обладают антитоксическими свойствами. Они способны адсорбировать токсины на своей поверхности, нейтрализовывать их или транспортировать к органам выделения.
Эозинофилы выделяют различные БАВ, большинство из которых по своим эффектам противоположны веществам, секретируе-мым базофилами и тучными клетками. Эозинофилы содержат ги-стаминазу — фермент, разрушающий гистамин, а также тормозят дальнейшее выделение гистамина базофилами. Эозинофилы способствуют свертыванию крови в отличие от базофилов. Установлено, что они фагоцитируют гранулы, выделяемые тучными клетками, в межклеточных пространствах. Все это позволяет организму снизить интенсивность аллергических реакций, защитить собственные ткани.
Миграцию эозинофилов из крови в ткани стимулируют базофилы и тучные клетки, а также лимфокины, простагландины, фактор активации тромбоцитов и иммуноглобулин Е. В свою очередь, эозинофилы стимулируют дегрануляцию базофилов и тучных клеток.
Уменьшение числа эозинофилов в крови (эозинопения) часто наблюдается при стрессах различной этиологии, оно обусловлено активацией гипофизарно-надпочечниковой системы. Увеличение числа эозинофилов (эозинофилия) отмечается при всех случаях интоксикации и при аллергических реакциях (в сочетании с базофилией).
Нейтрофилы. Нейтрофилы характеризуются высокой способностью к самостоятельному амебовидному передвижению, очень

 быстро переходят из крови в ткани и обратно, мигрируют по межклеточным пространствам. Они обладают хемотаксисом, то есть способностью двигаться в сторону химического или биологического раздражителя. Поэтому при попадании в организм микробных клеток, или продуктов их жизнедеятельности, или каких-то посторонних тел их прежде всего атакуют нейтрофилы. Передвижение нейтрофилов обеспечивают контрактильные (сократительные) белки — актин и миозин, находящиеся в их цитоплазме.
быстро переходят из крови в ткани и обратно, мигрируют по межклеточным пространствам. Они обладают хемотаксисом, то есть способностью двигаться в сторону химического или биологического раздражителя. Поэтому при попадании в организм микробных клеток, или продуктов их жизнедеятельности, или каких-то посторонних тел их прежде всего атакуют нейтрофилы. Передвижение нейтрофилов обеспечивают контрактильные (сократительные) белки — актин и миозин, находящиеся в их цитоплазме.
Нейтрофилы содержат ферменты, расщепляющие белки, жиры и углеводы. Благодаря набору активных ферментов нейтрофилы выполняют одну из главнейших функций — фагоцитоз. За открытие фагоцитоза великий русский ученый И. И. Мечников был удостоен Нобелевской премии. Сущность фагоцитоза заключается в том, что нейтрофилы устремляются навстречу чужеродной клетки, прилипают к ней, втягивают вместе с частью мембраны внутрь и подвергают внутриклеточному перевариванию. В процессе фагоцитоза участвуют щелочная и кислая фосфатаза, катепсин, лизо-цим, миелопероксидаза. Нейтрофилы фагоцитируют не только микроорганизмы, но и иммунные комплексы, образовавшиеся при взаимодействии антигена с антителом.
Фагоцитоз — это борьба не только с патогенными микроорганизмами, но и способ освобождения организма от собственных отмерших и мутантных клеток. Путем фагоцитоза происходит перестройка тканей организма, когда уничтожаются ненужные клетки (например, перестройка костных трабекул). Удаление неполноценных эритроцитов, избытка яйцеклеток или спермиев также происходит путем фагоцитоза. Таким образом, фагоцитоз проявляется постоянно в живом организме как способ сохранения гомеостаза и как одна из стадий физиологической регенерации тканей.
Важное значение нейтрофилов заключается также в выработке различных биологически активных веществ (БАВ). Эти вещества повышают проницаемость капилляров, миграцию других клеток крови в ткани, стимулируют кроветворение, рост и регенерацию тканей. Нейтрофилы вырабатывают бактерицидные, антитоксические и пирогенные вещества (пирогены — вещества, повышающие температуру тела, они вызывают лихорадочную реакцию при инфекционных или воспалительных заболеваниях). Нейтрофилы участвуют в свертывании крови и в фибринолизе.
Рассмотрим функции агранулоцитов — лимфоцитов и моноцитов.
Лимфоциты. Лимфоциты образуются в красном костном мозге, но на ранней стадии развития часть их покидает костный мозг и попадает в тимус, а часть — в фабрициеву сумку у птиц или ее аналоги у млекопитающих (предположительно — лимфатические узлы кишечника, миндалины). В этих органах происходит дальнейшее созревание и «обучение» лимфоцитов. Под обучением понимают приобретение мембраной лимфоцитов специфических
рецепторов, чувствительных к антигенам определенных видов микроорганизмов или чужеродных белков.
Таким образом, лимфоциты становятся неоднородными по своим свойствам и функциям. Различают три основные популяции лимфоцитов: Т-лимфоциты (тимусзависимые), созревающие в тимусе, или вилочковой железе; В-лимфоциты (бурсазависи-мые), созревающие в фабрициевой сумке у птиц и в лимфоидной ткани у млекопитающих; О-лимфоциты (нулевые), которые могут превращаться и в Т- и В-лимфоциты.
Т-лимфоциты после созревания в тимусе расселяются в лимфоузлах, селезенке или циркулируют в крови. Они обеспечивают клеточные реакции иммунитета. Т-лимфоциты неоднородны, среди них имеется несколько субпопуляций:
Т-хелперы (англ. help — помогать) — взаимодействуют с В-лим-фоцитами, превращают их в плазматические клетки, вырабатывающие антитела;
Т-супрессоры (англ. supress — подавлять) — понижают активность В-лимфоцитов, препятствуют их чрезмерной реакции;
Т-киллеры (англ. kill — убивать) — клетки-убийцы; разрушают чужеродные клетки, трансплантаты, опухолевые клетки, мутант-ные клетки и, таким образом, благодаря цитотоксическим механизмам сохраняют генетический гомеостаз.
Клетки иммунной памяти — хранят в памяти встреченные в течение жизни организма антигены, т. е. имеют на мембране рецепторы к ним. Согласно данным, эти клетки долгоживущие; у крыс, например, они сохраняются в течение всей их жизни.
Основная функция В-лимфоцитов — выработка антител, т. е. защитных иммуноглобулинов. Иммуноглобулины находятся на поверхности клеточных мембран В-лимфоцитов и выполняют роль рецепторов, связывающих антигены. Известно, что и Т-лимфоциты также имеют на своей поверхности иммуноглобулины.
Моноциты. Моноциты обладают высокой фагоцитарной активностью. Часть их мигрирует из крови в ткани и превращается в тканевые макрофаги. Они очищают кровяное русло, разрушают живые и погибшие микроорганизмы, уничтожают обломки тканей и отмершие клетки организма. Цитотоксическое действие моноцитов обусловлено наличием ферментов — миелопероксидазы и др.
Существенную роль играют моноциты в организации иммунного ответа. Моноциты, взаимодействуя своими рецепторами с антигеном, образуют комплекс (моноцит + антиген), в котором антиген распознается Т-лимфоцитами. Таким образом, значение моноцитов в иммунных реакциях заключается и в фагоцитозе, и в презентации, или в представлении антигена Т-лимфоцитам.
Моноциты участвуют в регенерации тканей, а также в регуляции гемопоэза, стимулируя образование эритропоэтинов и простаглан-динов.'Моноциты секретируют до 100 БАВ, в том числе интерлей-кины-1, пирогены и вещества, активирующие фибробласты, и др.
Лейкоцитарная формула, или лейкограмма. Лейкоцитарная формула — это содержание в крови отдельных классов лейкоцитов. Лейкоцитарная формула крови показывает количество базофилов, эозинофилов, нейтрофилов, лимфоцитов и моноцитов в процентах, т. е. на 100 клеток всех лейкоцитов. Зная процент каждого вида лейкоцитов и их общее содержание в крови, можно вычислить количество отдельных классов лейкоцитов в 1 л крови.
Лейкограмма может быть двух типов: нейтрофильная и лим-фоцитарная. Нейтрофильная формула, или нейтрофильный характер крови, характерна для лошадей, собак и многих других видов животных с однокамерным желудком: содержание нейтрофилов от 50 до 70 %. У жвачных животных в крови преобладают лимфоциты (от 50 до 70 %), и такой тип лейкограммы называется лимфоцитарным. У свиней примерно равное количество нейтрофилов и лимфоцитов, их лейкограмма имеет переходный тип.
В содержании других классов лейкоцитов видовые особенности несущественны: базофилов — 0...1 %, эозинофилов — 1...4 (у жвачных — до 6 %), моноцитов — 1...6 %.
При анализе лейкоцитарной формулы следует учитывать возраст животных. Так, у телят первых месяцев жизни, когда преджелудки еще недостаточно функционируют, лейкограмма имеет нейтрофильный характер. Увеличение числа нейтрофилов сверх нормы возможно у лошадей после изнурительной работы.
При заболеваниях соотношение между лейкоцитами может изменяться, при этом увеличение процента одного класса лейкоцитов сопровождается уменьшением других. Так, при нейт-рофилии обычно наблюдается лимфопения, а при лимфоцито-зе — нейтропения и эозинофилия; возможны и другие варианты. Поэтому для постановки диагноза необходимо учитывать и общее число лейкоцитов в крови, и лейкоцитарную формулу, а гематологические показатели сопоставить с клиническими проявлениями заболевания.
Тромбоциты, или кровяные пластинки, образуются из мега-кариоцитов костного мозга в результате отшнуровки частиц цитоплазмы.
Число тромбоцитов в крови животных может колебаться в больших пределах — от 200 до 600 Г/л: у новорожденных их больше, чем у взрослых; днем их содержится больше, чем ночью. Значительный тромбоцитоз, т. е. увеличенное содержание тромбоцитов в крови, отмечается при мышечной нагрузке, после приема корма и при голодании. Продолжительность жизни тромбоцитов от 4 до 9 сут.
Свойства и функции тромбоцитов. Тромбоциты участвуют во всех реакциях гемостаза. Прежде всего с их
непосредственным участием формируется тромбоцитарный, или микроциркуляционный, тромб. В тромбоцитах находится белок — тромбостенин, способный сокращаться подобно актомиозину мышечных клеток. При сокращении тромбостенина тромбоцит вместо дисковидной формы принимает сферическую, покрывается «щетиной» выростов — псевдоподий, что увеличивает контактную поверхность клеток и способствует их взаимодействию между собой. Происходит агрегация тромбоцитов, т. е. скопление их большого числа. Такие агрегаты можно увидеть в мазке, если кровь предварительно простояла какое-то время в пробирке. Если же мазок сделан из свежевыпущенной капли крови (при проколе кровеносного сосуда), то тромбоциты располагаются по отдельности между другими клетками крови. Агрегация тромбоцитов — процесс обратимый, при расслаблении тромбостенина тромбоциты снова приобретают дисковидную форму.
Тромбоциты обладают адгезивностыо (клейкостью). Они способны распластываться и приклеиваться к чужеродной поверхности, друг к другу, к сосудистой стенке. Адгезия — необратимый процесс, склеившиеся тромбоциты разрушаются. Адгезивность тромбоцитов повышается при беременности, травмах, хирургических вмешательствах; организм как бы заранее начинает готовиться к борьбе с возможными кровотечениями.
Из разрушенных склеившихся тромбоцитов выделяются тром-боцитарные факторы свертывания крови, участвующие в образовании протромбиназы и ретракции кровяного сгустка, а также вызывающие сокращение кровеносного сосуда.
Функции тромбоцитов не ограничиваются только гемостазом. Ежедневно около 15 % тромбоцитов прилипают к эндо-телиоцитам и изливают в них свое содержимое, за это их называют «кормильцами» эндотелия сосудов. Очевидно, эндо-телиальные клетки не могут в достаточном количестве извлекать необходимые им вещества из плазмы крови. Если лишить их тромбоцитарной «подкормки», то они быстро подвергаются дистрофии, становятся ломкими и начинают пропускать макромолекулы и даже эритроциты.
Тромбоциты содержат в своем составе железо, медь, дыхательные ферменты и могут наряду с эритроцитами транспортировать в крови кислород. Это приобретает значение в тех случаях, когда организм находится в состоянии значительной гипоксии — при максимальной физической нагрузке, низком содержании кислорода в воздухе. Есть данные, что тромбоциты способны к фагоцитозу. Они синтезируют так называемый тромбоцитарный фактор роста, ускоряющий регенеративные процессы в тканях. Однако основная функция тромбоцитов — предотвращение или остановка кровотечения, а все остальные — резервные, дополняющие роль эритроцитов или лейкоцитов.
 3.7. РЕГУЛЯЦИЯ КРОВЕТВОРЕНИЯ
3.7. РЕГУЛЯЦИЯ КРОВЕТВОРЕНИЯ
Кроветворение, или гемопоэз, — это процессы размножения (пролиферации), дифференцировки (специализации) и созревания форменных элементов крови. Число форменных элементов в крови у здоровых животных колеблется в небольших пределах и быстро восстанавливается до физиологического благодаря регуляции процессов кроветворения, кроверазрушения и перераспределения крови между кровяными депо и циркулирующей кровью.
В эмбриональном периоде первые кроветворные очаги появляются в желточном мешке; затем, по мере закладки и развития внутренних органов, кроветворение происходит в печени, селезенке, тимусе, лимфатических узлах, костном мозге. После рождения все клетки крови образуются только в красном костном мозге, а экстрамедуллярное кроветворение (вне костного мозга) может наблюдаться при заболеваниях.
Кроветворный костный мозг расположен главным образом в плоских костях — в грудной кости, костях таза, в ребрах, отростках позвонков, в черепных костях. У молодых животных кроветворный аппарат находится и в трубчатых костях, но в дальнейшем он, начиная со средней части кости, замещается желтым (жировым) костным мозгом и очаги кроветворения сохраняются только в эпифизах (головках), а у старых животных гемопоэз в трубчатых костях отсутствует.
Все клетки крови происходят из одной клетки костного мозга — стволовой клетки. Эти клетки называются полипотентны-ми, т. е. клетками разных возможностей (греч. poly — наибольший, potentia — способность, потенция). Стволовые полипотент-ные клетки (СПК) пребывают в неактивном состоянии и начинают размножаться в тех случаях, когда необходима регенерация клеток крови. Из стволовых клеток в ходе их дальнейшей дифференцировки развиваются все клетки крови — эритроциты, лейкоциты и тромбоциты.
Стволовые клетки окружены ретикулярными клетками, фиб-робластами, ретикулиновыми волокнами. Здесь же находятся макрофаги, эндотелиальные клетки кровеносных сосудов. Все эти клетки и волокна формируют так называемое микроокружение стволовых клеток. Микроокружение, или ниша стволовых клеток, в одних случаях ограждает СПК от дифференцирующих стимулов и тем самым способствует их самоподдержанию в неактивном состоянии или, наоборот, оказывает влияние на дифференцировку СПК в направлении миелопоэза или лимфопоэза.
В периферической крови стволовые клетки присутствуют в очень небольшом количестве, примерно 0,1 % от всех стволовых клеток костного мозга. Выявление их в крови методически сложное не только из-за малого числа, но и потому, что морфологически они очень похожи на лимфоциты. Физиологическое значение
циркуляции в крови стволовых клеток, очевидно, заключается в том, чтобы равномерно заселить ими костный мозг, участки которого анатомически разобщены.
В регуляции кроветворения участвуют нервные и гуморальные механизмы. Еще в работах С. П. Боткина и И. П. Павлова было доказано влияние ЦНС на клеточный состав крови. В частности, хорошо известны факты условно-рефлекторного эритроцитоза или лейкоцитоза. Следовательно, на кроветворение оказывает влияние кора больших полушарий. Единый центр кроветворения (по аналогии с пищевым или дыхательным) не обнаружен, но большое значение в регуляции гемопоэза отводится гипоталамусу — отделу промежуточного мозга.
В кроветворных органах имеется большое число нервных волокон и нервных окончаний, осуществляющих двустороннюю связь кроветворного аппарата с ЦНС. Поэтому нервная система оказывает прямое влияние на размножение, созревание клеток и на разрушение лишних клеток.
Влияние ЦНС на кроветворение осуществляется через вегетативную нервную систему. Как правило, симпатическая нервная система стимулирует кроветворение, а парасимпатическая — угнетает.
Помимо прямого контроля за деятельностью костного мозга ЦНС влияет на кроветворение через образование гуморальных факторов. Под воздействием нервных импульсов в тканях некоторых органов образуются гемопоэтины — гормоны белковой природы. Гемопоэтины воздействуют на микроокружение СПК, определяя их дифференцировку. Различают несколько видов гемопоэ-тинов — эритропоэтины, лейкопоэтины, тромбоцитопоэтины. По своим функциям гемопоэтины относятся к цитомединам — веществам, осуществляющим контакт между клетками. Кроме гемо-поэтинов в регуляции гемопоэза участвуют и другие биологически активные вещества — как эндогенные, образующиеся в организме, так и экзогенные, поступающие из внешней среды. Такова общая схема регуляции гемопоэза. В механизме регуляции числа отдельных видов клеток крови имеются особенности.
Регуляция эритропоэза. Постоянно действующим физиологическим регулятором эритропоэза является эритропоэтин.
У здорового животного, если ему ввести плазму крови от другого животного, перенесшего кровопотерю, возрастает число эритроцитов в крови. Это объясняется тем, что после крово-потери уменьшается кислородная емкость крови и возрастает выработка эритропоэтина, который и активизирует эритропоэз костного мозга.
Эритропоэтин образуется в почках и активизируется при взаимодействии с глобулином крови, который образуется в печени. Образование эритропоэтина стимулируется при уменьшении содержания кислорода в тканях — например, при кровопотере, при длительном нахождении животных в условиях пониженного
9 — 3389
барометрического давления, при систематических тренировках спортивных лошадей, а также при заболеваниях, связанных с нарушением газообмена. Стимуляторами эритропоэза являются продукты распада эритроцитов, кобальт, мужские половые гормоны.
В организме имеются также ингибиторы эритропоэтина — вещества, подавляющие его выработку. Ингибитор эритропоэтина активизируется при повышенном содержании кислорода в тканях — например, снижение числа эритроцитов в крови у высокогорных жителей после попадания в местность на уровне моря. Ингибитор эритропоэтина обнаружен у новорожденных в первые дни и недели жизни, вследствие чего число эритроцитов у них снижается до уровня взрослого животного.
Таким образом, выработка эритроцитов регулируется посредством колебания содержания кислорода в тканях путем обратной связи, а реализуется этот процесс через образование эритропоэтина, его активацию или ингибирование.
Довольно значительна в эритропоэзе роль кормовых факторов. Для полноценного эритропоэза необходимо достаточное содержание в кормах белков, аминокислот, витаминов В2, В6, Bi2, фолиевой кислоты, аскорбиновой кислоты, железа, меди, магния, кобальта. Эти вещества входят либо в гемоглобин, либо в состав ферментов, участвующих в его синтезе.
Витамин Bi2 называют внешним фактором кроветворения, так как он поступает в организм с кормом. Для его усвоения необходим внутренний фактор — муцин (гликопротеид) желудочного сока. Роль муцина заключается в защите молекул витамина В12 от разрушения микроорганизмами, заселяющими кишечник. Совокупность витамина Bj2 и муцина желудочного сока называют «фактор Боткина — Касла» — по фамилиям ученых, открывших этот механизм.
Регуляция лейкопоэза. Пролиферацию и дифференцировку лейкоцитов индуцируют лейкопоэтины. Это тканевые гормоны, которые образуются в печени, селезенке, почках. В чистом виде они пока не выделены, хотя известно об их неоднородности. Среди них различают эозинофилопоэтины, базофилопоэтины, нейтрофилопоэтины, моноцитопоэтины. Каждый вид лейко-поэтинов стимулирует лейкопоэз специфично — в направлении увеличения образования эозинофилов, базофилов, нейтрофилов или моноцитов. Главным регулятором образования и дифференцировки Т-лимфоцитов является гормон тимуса — тимопоэтин.
Не вызывает сомнения также то, что в организме образуются стимуляторы и ингибиторы лейкопоэтинов. Они находятся между собой в определенных взаимоотношениях для поддержания баланса между отдельными классами лейкоцитов (например, между нейтрофилами и лимфоцитами).
Продукты распада лейкоцитов стимулируют образование новых клеток того же класса. Поэтому чем больше клеток разруша-
ется в ходе защитных реакций, тем больше новых клеток выходит из кроветворных органов в кровь. Так, при образовании гнойника (абсцесса) в пораженном участке скапливается большое количество нейтрофилов, осуществляющих фагоцитоз. Значительная часть нейтрофилов при этом погибает, из клеток выделяются различные вещества, в том числе и те, которые стимулируют образование новых нейтрофилов. В результате в крови наблюдается высокая ней-трофилия. Это — защитная реакция организма, направленная на усиление борьбы с патогенным агентом.
В регуляции лейкопоэза участвуют железы внутренней секреции — гипофиз, надпочечники, половые железы, тимус, щитовидная железа. Например, адренокортикотропный гормон гипофиза вызывает снижение содержания эозинофилов в крови вплоть до полного их исчезновения и увеличивает количество нейтрофилов. Такое явление часто наблюдается у здоровых животных в условиях длительного стресса.
Регуляция тромбоцитопоэза. Число тромбоцитов в крови, так же как и других форменных элементов, регулируется нейрогумораль-пыми механизмами. Гуморальные стимуляторы называются тром-боцитопоэтинами, они ускоряют образование мегакариоцитов в костном мозге из их предшественников, а также их пролиферацию и созревание.
При различных экспериментальных исследованиях и клинических наблюдениях за больными обнаружены и ингибиторы образования тромбоцитов. Очевидно, только при уравновешивании ноздействий стимуляторов и ингибиторов поддерживается оптимальный уровень образования тромбоцитов и их содержания в периферической крови.
Итак, у здоровых животных поддерживается постоянное число форменных элементов в крови, но при различных физиологических состояниях или при внешних воздействиях в организме может изменяться концентрация отдельных клеток или их соотношение.)ти изменения происходят либо быстро, путем перераспределения имеющегося запаса клеток между органами и тканями, либо медленно, но более продолжительно во времени — благодаря изменению скорости кроветвор
|
|
|


