 |
Аллотропия. Химические соединения и смеси.
|
|
|
|
Лекция 1. Основные химические понятия.
План
1. Определение и предмет химии.
Молекулы. Молекулярные массы. Элементный состав веществ.
Простые и сложные вещества.
Аллотропия. Химические соединения и смеси
4. Валентность элементов. Графические формулы веществ.
Моль. Молярная масса.
5. Классификация неорганических веществ.
1. Определение и предмет химии.
В первом разделе вы повторите основные положения атомно-молекулярной теории, понятия «Атом», «молекула», «относительная атомная и относительная молекулярная массы», «моль», и «молярная масса», «валентность», закон постоянства состава вещества, закон сохранения массы, закон Авогадро.
При изучении этого раздела вы потренируетесь в расчетах по химическим формулам и химическим уравнениям.
Химия – наука о веществах, их строении, свойствах и превращениях.
Химические свойства вещества – это способность данного вещества превращаться в другие вещества.
Превращения одних веществ в другие называются химическими реакциями, или химическими явлениями. В результате химических реакций всегда образуются новые вещества. Исходные вещества, которые вступают в химическую реакцию, называются реагентами, а новые вещества, которые образуются в результате химической реакции, называются продуктами реакции.
Вопросы для контроля.
1. Дайте определение химии как науки.
2. Что такое химические свойства вещества?
3. Что называется химическими реакциями?
4. Что называется реагентами?
5. Что называется продуктами реакции?
2. Молекулярные массы. Элементный состав веществ.
Атомы могут соединяться друг с другом. В результате этого соединения обычно образуются более сложные частицы – молекулы.
|
|
|
Состав любой молекулы можно выразить химической формулой.
Так, молекула водорода имеет формулу Н2. Число «2» в этой формуле показывает число атомов водорода в молекуле водорода.
Числа в химических формулах, которые показывают, сколько атомов данного элемента входит в состав молекулы, называются индексами.
Таким образом, химические формулы показывают качественный и количественный состав молекулы (из атомов каких элементов состоит молекула и сколько этих атомов в молекуле).
Согласно закону постоянства состава (Ж. Пруст, Франция, 1808 г.):
Каждое чистое вещество имеет постоянный качественный и количественный состав, который не зависит от способа получения вещества.
Молекула – это наименьшая частица вещества, которая сохраняет его химические свойства.
Масса любой молекулы равна сумме масс образующих ее атомов. Если при расчете массы молекулы используются относительные атомные массы, то получается относительная молекулярная масса, которая обозначается символом Мr.
Массовая доля (w) химического элемента в данном веществе равна отношению относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества:
Ar(X)*n
 ω (X) =
ω (X) =
Мr
Вопросы для контроля
1. Какие частицы обычно образуются в результате соединения атомов?
2. Чем можно выразить состав любой молекулы?
3. Что называется индексами в химических формулах?
4. Что показывают химические формулы?
5. Как формулируется закон постоянства состава?
6. Что такое молекула?
7. Чему равна масса молекулы?
8. Что такое относительная молекулярная масса?
9. Чему равна массовая доля данного элемента в данном веществе?
Рефлексия:
|
|
|
Задания для самостоятельной работы
1. Опишите качественный и количественный состав молекул следующих веществ: метан СН4, сода Na2CO3, глюкоза C6H12O6, хлорCI2, сульфат алюминия AI2(SO4)3/
2. Молекула фосгена состоит из одного атома углерода, одного атома кислорода и двух атомов хлора. Молекула мочевины состоит из одного атома углерода, одного атома кислорода и двух атомных групп NH2. Напишите формулы фосгена и мочевины.
3. Подсчитайте общее число атомов в следующих молекулах: (NH4)3PO4, Са(H2PO4)2, [Fe(OH)2]2SO4.
4. Рассчитайте относительные молекулярные массы веществ, которые указаны в упражнении 1.
5. Чему равны массовые доли элементов в следующих веществах: NH3, N2O, NO2, NaNO3, KNO3, NH4NO3? В каком из этих веществ массовая доля азота наибольшая и в каком – наименьшая?
Простые и сложные вещества.
Аллотропия. Химические соединения и смеси.
Все вещества делятся на простые и сложные.
Простые вещества – это вещества, которые состоят из атомов одного элемента.
Сложные вещества – это вещества, которые состоят из атомов разных элементов.
Сложные вещества часто называют химическими соединениями. В химических соединениях свойства простых веществ, из которых образуются эти соединения, не сохраняются. Свойства сложного вещества отличаются от свойств простых веществ, из которых оно образуется.
Рефлексия:
Вопросы для контроля
1. На какие два типа делятся все вещества.
2. Что такое простые вещества.
3. Что такое сложные вещества?
4. Сохраняются ли свойства простых веществ при образовании из них сложного вещества.
Задания для самостоятельной работы
1. Напишите формулы известных вам:
а) простых веществ (5 примеров);
б) сложных веществ (5 примеров)
4. Валентность элементов. Графические формулы веществ.
Валентность элемента – это способность атома данного элемента присоединять определенное число других атомов с образованием химических связей.
Некоторые элементы имеют постоянную валентность.
Элементы с Постоянной валентностью – это элементы которые во всех соединениях проявляют одинаковую валентность.
Элементами с постоянной валентностью I являются: водород H, фторF, щелочные металлы: литийLi, натрийNa, калийK и др.
|
|
|
Атомы этих одновалентных элементов всегда образуют только одну химическую связь.
Элементы с постоянной валентностью II:
КислородO, магнийMg, кальцийCa, стронцийSr, барийBa, цинкZn.
Элемент с постоянной валентностью III – алюминий Al. Большинство элементов имеют переменную валентность.
Элементы с переменной валентностью – это элементы, которые в разных соединениях могут иметь различные значения валентности.
Для определения валентности таких элементов в каком-либо данном соединении можно использовать правило валентности.
Согласно этому правилу, в большинстве бинарных соединений типа АmBn произведение валентности элемента А (х) на число его атомов (m)равно произведению валентности элемента В (у) на число его атомов (n).
X*m=y*n
Рефлексия
Вопросы для контроля
1. Что такое валентность элемента?
2. Какими цифрами обычно обозначается валентность?
3. Что такое элементы с постоянной валентностью?
4. Какие элементы имеют постоянную валентность?
5. Сто такое элементы с переменнной валентностью? Укажите наиболее характерные значения валентности для хлора, серы, углерода, фосфора, железа.
6. Как формулируется правило валентности?
Задания для самостоятельной работы
1. Определите валентность элементов в следующих соединениях: AsH3, CuO, N2O3, CaBr2, ALI3, SF6, K2S, SiO2, Mg3N2/
2. Определите индексы m иn в следующих формулах:
II III I IV III II
HmSen, PmCln, PbmOn, OmFn, FemSn
Напишите графические формулы этих веществ.
3. Составьте формулы соединений, которые состоят из: а) марганца (II) и кислорода; б) марганца (IV) и кислорода; в) марганца (VI) и кислорода; г) хлора (IIV) и кислорода; д) бария и кислорода.
Напишите графические формулы этих веществ.
Моль. Молярная масса.
Масса вещества выражается в кг, г или других единицах массы.
Единицей количества вещества является моль.
Большинство веществ состоит из молекул или атомов.
Моль – это количество вещества, которое содержит столько молекул (атомов) этого вещества, сколько атомов содержится в 12 г (0,012 кг) углерода С.
Из определения понятия «моль» следует, что это число равно числу молекул (атомов) в одном моле любого вещества. Оно называется числом Авогадро и обозначается символом Na:
|
|
|
 Na≈6.02*1023молекул (атомов) ≈ 6,02*1023 моль -1
Na≈6.02*1023молекул (атомов) ≈ 6,02*1023 моль -1
Моль
Молярная масса вещества М выражается в г/моль, то она численно равна относительной молекулярной массе этого вещества Мr.
Если вещество состоит из атомов, то его молярная масса М в г/моль численно равна относительной атомной массе Аr.
Зная молярную массу вещества М, можно рассчитать количество вещества (число молей) nв любой данной массе m этого вещества по формуле:
n = 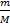
Рефлексия
Вопросы для контроля
1. В каких единицах выражается масса вещества?
2. Что является единицей количества вещества?
3. Что такое моль?
4. Как обозначается и чему равно число Авогадро?
5. Сколько молекул содержит 1 моль любого вещества?
6. Как назевается масса 1 моля вещества и в каких единицах она выражается?
7. Чему численно равна молярная масса вещества, которое состоит из: а) молекул; б) атомов?
Задания для самостоятельной работы
1. Сколько молекул содержится в: а) 0,5 моль вещества; б) 3 моль вещества?
2. Сколько молей составляют и сколько атомов содержат:
а)8 г серы S, б) 280 г железаFe, в) 3,2 кг меди Cu?
3. Определите массу: а) 0,1 моль Н2; б) 5 моль СО2; в) 1,5 моль CuSO4, г) 2,5 моль Mg, д) 10-3 мольH3PO4.
4. Масса 3 моль вещества равна 51 г. Чему равны молярная масса и относительная молекулярная масса этого вещества?
5. Сколько молей атомов азота содержится в 16 г нитрата аммония NH4NO3
5. Классификация неорганических веществ.
Все неорганические вещества можно разделить на классы.
Все неорганические вещества делятся на простые и сложные.
Простые вещества подразделяются на металлы, неметаллы и инертные газы.
Важнейшими классами сложных неорганических веществ являются: оксиды, основания, кислоты, амфотерные гидроксиды, соли.
Оксиды – это соединения двух элементов, один из которых кислород. Общая формула оксидов:
ЭmOn
Основания – это сложные вещества, молекулы которых состоят из атома металла и одной или нескольких гидроксидных групп – ОН. Общая формула оснований:
Me(OH)y
Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металла. Общая формула кислот:
Нх(Ас)
Амфотерные гидроксиды – это сложные вещества, которые имеют свойства кислот и свойства оснований. Поэтому формулы амфотерных гидроксидов можно записывать в форме оснований и в форме кислот.
Рефлексия
Вопросы для контроля
1. Назовите важнейшие классы сложных неорганических веществ.
2. Что такое оксиды? Приведите примеры.
|
|
|
3. Что такое основания? Приведите примеры.
4. Что такое кислоты? Приведите примеры.
5. Что такое амфотерные гидроксиды? Приведите примеры.
6. Что такое соли? Приведите примеры.
Упражнения для самостоятельной работы
1. Напишите формулы 5 оксидов, 5 оснований, 5 солей (при выполнении задания не повторяйте те примере, которые приведены в тексте задания)
2. Классифицируйте следующие сложные неорганические вещества:NaCI, H2SO4, Zn(OH)2, CaO, P2O5, HMnO4, KOH, Cu(NO3)2, HCI, AI2O3, Cu(OH)2, AI2(SO4
Литература:
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / Габриелян О.С., Остроумов
И.Г.. – М., 2012
Раздел 1.
Глава 1. Основные понятия и законы химии
§1.1-1.4, стр 5-24
|
|
|


