 |
Электронные конфигурации атомов
|
|
|
|
Структура таблицы Менделеева.
1. Вертикальные столбцы – группы; группы делятся на подгруппы – главную и побочную. Главная подгруппа включает элементы больших и малых периодов, побочная – только больших.
2. Периоды – горизонтальные ряды элементов, которые начинаются со щелочного металла и заканчиваются благородным газом (кроме первого периода, он начинается с водорода).
3. Физический смысл порядкового номера: он соответствует числу протонов в ядре, следовательно, он равен заряду ядра, числу электронов в атоме.
4. Физический смысл номера группы: он соответствует числу валентных электронов у атомов (числу электронов, которые могут быть задействованы на образование химических связей).
5. Физических смысл номера периода: он соответствует числу энергетических уровней в атоме (заполняемых электронами в основном состоянии атома)
Пользуясь таблицей Менделеева, можно определить, металлом или неметаллом является элемент (с некоторыми исключениями):
если провести линию от бериллия (Ве) до астата (At), то над линией в главных подгруппах окажутся неметаллы (водород – неметалл), все остальные элементы – металлы.
Строение атома.
1. Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Атомное ядро – центральная часть атома, состоящая из нуклонов – протонов и нейтронов, связанных между собой ядерными силами.
2. Электронная оболочка – совокупность движущихся вокруг ядра электронов.
Таблица 1. Элементарные частицы, входящие в состав атома.
| название частицы | обозначение | Заряд частицы | масса частицы (в атомных единицах массы) |
| Протон | р+ | +1 | 1 а.е.м. |
| Нейтрон | n0 | 0 | 1 а.е.м. |
| Электрон | е- | -1 | 1/1840 от массы протона |
|
|
|
3. Заряд ядра атома соответствует атомному (порядковому) номеру элемента в периодической системе (Z).
Так как атом - электронейтральная частица, то число протонов N(p) должно быть равно числу электронов N(e-) (число + = числу -):
N(e-) = N(p) = Z
4. Массовое число А – складывается из числа протонов и нейтронов в ядре данного атома. Тогда число нейтронов легко найти, вычитая заряд ядра атома из массового числа.
А = N(p) + N(n) N(n) = A – Z
Пример: определить число протонов и нейтронов в ядре атома мышьяка с массовым числом 75.
 массовое число
массовое число
75
заряд ядра атома 33 As
Решение: порядковый номер у As – 33. Следовательно, заряд ядра Z= +33, число протонов – 33. Число нейтронов: A – Z = 75 – 33 = 42.
5. Химический элемент – вид атомов с определённым зарядом ядра.
Природа устроена так, что один и тот же элемент может существовать в виде двух или нескольких изотопов (существуют элементы, которые в природе представлены только одним изотопом, например, фосфор и фтор).
6. Изотопы – атомы с одинаковым зарядом ядра, но разным массовым числом, т.е. разным числом нейтронов в ядре.
Поскольку нейтроны практически не влияют на химические свойства элементов, все изотопы одного и того же элемента химически неотличимы.
Пример: изотопы углерода: 12С и 13С. Значит, они отличаются по составу на 1 нейтрон: у 12С – 6 нейтронов, у 14С – 7 нейтронов.
Водород имеет три изотопа: протий 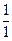 Н, дейтерий (D)
Н, дейтерий (D) 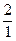 Н и тритий (T)
Н и тритий (T)  Н
Н
Электронное строение атома.
1. Электронная оболочка атома состоит из электронных слоев или уровней.
Номер периода, в котором находится атом данного химического элемента, показывает число энергетических слоев (уровней) в его атоме. Электронные уровни обозначаются целыми числами 1, 2,.., n, начиная от ближайшей к ядру.
|
|
|
2. Номер группы, в которой находится атом данного химического элемента, соответствует числу электронов на внешнем слое атома (это справедливо только для элементов главных подгрупп).
Например: на внешнем слое атома хлора находится 7 электронов (это элемент 7 группы).
3. На внешнем слое атомов элементов побочных подгрупп находится почти всегда 2 электрона (по 1 электрону на внешнем слое у атомов хрома, молибдена, меди, серебра и золота – из-за проскока электрона (правило см.ниже)).
4. Максимальное количество электронов на уровне можно определить по формуле:
N=2n2 , где n – номер уровня, для которого мы делаем расчет, а N – максимально возможное число электронов на слое. В соответствии с этой формулой на 1 слое не может быть больше 2-х электронов, на 2-ом – более 8, на 3-ем – более 18 и т.д.
) ) ) )
2 8 18 32
5. Если уровень содержит максимально возможное число электронов, его называют завершенным. Если меньше максимального, то незавершенным.
6. На внешнем слое атомов не может содержаться более 8-ми электронов (у атомов 1 периода – более 2-х).
Атомы химических элементов стремятся к тому, чтобы их внешние уровни были завершенными (как у инертных газов).
Для этого в ходе химических реакций атомы металлов отдают электроны, а атомы неметаллов – принимают. При этом атомы металлов превращаются в соответствующие катионы, а атомы неметаллов – в соответствующие анионы (между полученными частицами возникает ионная связь).
Na0) ) ) -1 е = Na+) )
2 8 1 2 8
заряд ядра равен +11, заряд электронов – 11, заряд ядра равен +11, заряд электронов – 10,
в сумме заряд равен нулю в сумме заряд равен +1.
Cl0) ) ) +1 е = Cl-) ) )
2 8 7 2 8 8
заряд ядра равен +17, заряд электронов – 17, заряд ядра равен +17, заряд электронов – 18,
|
|
|
в сумме заряд равен нулю в сумме заряд равен -1.
7. Уровни, в свою очередь, могут состоять из близких по энергии подуровней. Их обозначают символами s, p, d, f.
Подуровни, в свою очередь, состоят из одинаковых по энергии орбиталей. На каждой орбитали может быть не больше двух электронов.
На схеме орбитали обозначают в виде ячеек: ¨, а электроны - в виде стрелок: или ¯.
(Электроны при движении создают облако определенной формы см. интернет)
Электронные конфигурации атомов
- Распределение электронов по подуровням называется электронной конфигурацией, а по орбиталям – графической.
- На каждом s-подуровне (одна орбиталь) могут находиться два электрона, на каждом p-подуровне (три орбитали) - шесть электронов, на каждом d-подуровне (пять орбиталей) - десять электронов.
Электронная формула атома – запись распределения электронов по орбиталям атома:
1s22s22p63s23p6...
Число электронов на орбиталях данного подуровня указывается в верхнем индексе справа от буквы, например 3d5 - это 5 электронов на 3d-подуровне.
Например, электронная формула атома хлора 1s22s22p63s23p5.
3. Порядок заполнения электронных подуровней определяется правилом Клечковского:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d
4. Тот подуровень, который заполняется у атома последним, определяет его принадлежность к определенному электронному семейству, например: 1s22s22p63s23p5 хлор является р-элементом; 1s22s22p63s2 магний является s-элементом, 1s22s22p63s23p54 s23 d1 скандий является d-элементом.
|
|
|


