 |
Методика изучения основ молекулярно-кинетической теории в систематическом курсе физики
|
|
|
|
Изучение этой темы основывается на знании учащихся, полученных при изучении курса в 7-8 классах и курса химии в 8-9 классах. Центральное понятие этой темы – понятие молекулы; сложность его усвоения связана с тем, что молекула – объект, непосредственно ненаблюдаемый. Поэтому учитель должен убедить 9-ков в реальности микромира, в возможности его познания. В связи с этим большое внимание уделяют рассмотрению экспериментов, доказывающих существование и движение молекул и позволяющих вычислить их основные характеристики. Кроме этого, целесообразно ознакомить учащихся с расчетными методами определения характеристик молекул. Положения МКТ: 1. Все вещества состоят из молекул. 2. Эти молекулы хаотично и непрерывно движутся. 3. Молекулы взаимодействуют между собой. При рассмотрении броуновского движения необходимо сделать следующие выводы: 1. Движение броуновских частиц вызывается ударами молекул вещества о стенки сосуда, в котором они взвешены. 2. Броуновское движение непрерывно и бесконечно. Оно зависит от свойств вещества, в котором эти частицы взвешены. 3. Движение броуновской частицы позволяет судить о движении молекулы среды, в котором частицы находятся. 4. Броуновское движение доказывают существование молнии, их движение которое носит непрерывный и хаотичный характер этого движения. Вопрос о взаимодействии молекул школьники уже изучали в 10 классе, знания поэтому нужно углубить. Межмолекулярные взаимодействия имеют электромагнитную природу; межмолекулярные взаимодействие характеризуется силами притяжения и отталкивания; силы межмолекулярного взаимодействия действуют на расстояниях не больше 2-3 диаметров молекул. На этом расстоянии заметна лишь сила притяжения, силы отталкивания практически равны нулю; по мере уменьшения расстояния между молекулами силы взаимодействия увеличиваются. Сила отталкивания растет быстрее, чем сила притяжения. Относительной молекулярной (атомной) массой называется отношение массы молекулы данного вещества к 1/12 массы атома углерода.  Количество вещества – это отношение числа молекул, содержащихся в данном теле к числу атомов, которое содержится в 0,012 кг углерода.
Количество вещества – это отношение числа молекул, содержащихся в данном теле к числу атомов, которое содержится в 0,012 кг углерода.  ,
,  Моль – это количество вещества, содержащее в себе столько структурных элементов, сколько атомов содержится в 0,012 кг углерода. Молярная масса – масса 1 моля вещества
Моль – это количество вещества, содержащее в себе столько структурных элементов, сколько атомов содержится в 0,012 кг углерода. Молярная масса – масса 1 моля вещества  Если найдем связь между количеством вещества, массой вещества и молекулярной массой, получим:
Если найдем связь между количеством вещества, массой вещества и молекулярной массой, получим:  . Идеальный газ – это газ состоящий из большого количества молекул, которые представляют собой материальные точки, не взаимодействующие друг с другом, на расстоянии, но взаимодействуют при столкновении по закону абсолютно упругого удара. Принимая молекулу газа за материальную точку, исходят из того, что суммарный объем меньше объема сосуда и его можно не учитывать. Следует отметить, что принятая модель идеального газа работает только тогда, когда газ находится в равновесном состоянии. Эта модель не применима при высоких давлениях и низких температурах.
. Идеальный газ – это газ состоящий из большого количества молекул, которые представляют собой материальные точки, не взаимодействующие друг с другом, на расстоянии, но взаимодействуют при столкновении по закону абсолютно упругого удара. Принимая молекулу газа за материальную точку, исходят из того, что суммарный объем меньше объема сосуда и его можно не учитывать. Следует отметить, что принятая модель идеального газа работает только тогда, когда газ находится в равновесном состоянии. Эта модель не применима при высоких давлениях и низких температурах.  Доказательство уравнения можно разбить на 4 этапа: 1. Найдем импульс, приобретенный стенкой при ударе одной молекулы газа. mo – масса одной молекулы. Разложим силы на составляющие:
Доказательство уравнения можно разбить на 4 этапа: 1. Найдем импульс, приобретенный стенкой при ударе одной молекулы газа. mo – масса одной молекулы. Разложим силы на составляющие:  ,
,  2. Найдем число молекул, которое возможно дойдут до стенки dC. Число молекул в объеме – половина -
2. Найдем число молекул, которое возможно дойдут до стенки dC. Число молекул в объеме – половина -  3.Общий импульс, полученный стенками сосуда будет
3.Общий импульс, полученный стенками сосуда будет  Из механики известно, что импульс силы равен изменению импульса тела
Из механики известно, что импульс силы равен изменению импульса тела  ,
, 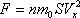 4.
4.  ,
,  ,
,  .
.  , - средняя квадратичная скорость.
, - средняя квадратичная скорость.  - основное уравнение МКТ.
- основное уравнение МКТ.  . Температура характеризует внутреннее состояние изолированной системы тел, находящихся в состоянии термодинамического равновесия. Можно встретить следующее определение температуры: Предельн Т, при которой давление идеального газа становится равным нулю, при постоянном объеме или объем газа становится равным нулю при определенном давлении, называется абсолютным нулем температур. Учитывая, что
. Температура характеризует внутреннее состояние изолированной системы тел, находящихся в состоянии термодинамического равновесия. Можно встретить следующее определение температуры: Предельн Т, при которой давление идеального газа становится равным нулю, при постоянном объеме или объем газа становится равным нулю при определенном давлении, называется абсолютным нулем температур. Учитывая, что  ,
,  ,
,  ,
,  , то есть температура является мерой средней кинетической энергии движения молекул. Газовые законы могут изучаться индуктивно, либо дедуктивно. При индуктивном подходе газовые законы изучаются как эмпирические, полученные при обобщении данных эксперимента, а затем выводят уравнения состояния идеального газа. Закон Бойля-Мариота. Открыт экспериментально. Р. Бойль – 1662г. Э. Мариот – 1667г. При постоянной температуре объем данной массы газа обратно пропорционально давлению. PV = const – изотермический процесс T = const,
, то есть температура является мерой средней кинетической энергии движения молекул. Газовые законы могут изучаться индуктивно, либо дедуктивно. При индуктивном подходе газовые законы изучаются как эмпирические, полученные при обобщении данных эксперимента, а затем выводят уравнения состояния идеального газа. Закон Бойля-Мариота. Открыт экспериментально. Р. Бойль – 1662г. Э. Мариот – 1667г. При постоянной температуре объем данной массы газа обратно пропорционально давлению. PV = const – изотермический процесс T = const,  . Для данной массы газа произведение давления на объем постоянно, если температура постоянна. По оси у – V, по x – P, графическая зависимость – изотерма. Закон Гей-Люсака. Открыт экспериментально в 1802г. При постоянном давлении объем данной массы газа зависит от температуры по линейному закону.
. Для данной массы газа произведение давления на объем постоянно, если температура постоянна. По оси у – V, по x – P, графическая зависимость – изотерма. Закон Гей-Люсака. Открыт экспериментально в 1802г. При постоянном давлении объем данной массы газа зависит от температуры по линейному закону.  , процесс – изобарный
, процесс – изобарный  . Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется. По оси х – t, y – V. График – изобара. Предположим, что имеем 1 моль газа. Газ характеризуется параметрами
. Для данной массы газа отношение объема к температуре постоянно, если давление газа не меняется. По оси х – t, y – V. График – изобара. Предположим, что имеем 1 моль газа. Газ характеризуется параметрами  , Ро=101325 Па, Vom=22.4 л = 22,4 10-3 м3.
, Ро=101325 Па, Vom=22.4 л = 22,4 10-3 м3.  ,
,  - универсальная газовая постоянная. R = 8.31 Дж/К.
- универсальная газовая постоянная. R = 8.31 Дж/К.  ,
,  - уравнение Менделеева – Клайперона. Другой вывод уравнения М-К. Известно, что давление газа описывается согласно основному уравнению МКТ
- уравнение Менделеева – Клайперона. Другой вывод уравнения М-К. Известно, что давление газа описывается согласно основному уравнению МКТ 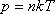 (4)
(4)  (5)
(5)  ,
,  ,
,  (6) – это соотношение найдено фр. Физиком Клайпероном в 1834г. Он хотя и связал все параметры, характеризующие состояние газа, но это уравнение не удобно для практического применения. Дело в том, что в него, помимо P, V, T входят не измеряемые на опыте число молекул N. В 1874 г. Менделеев усовершенствовал эту формулу, ввел в нее массу:
(6) – это соотношение найдено фр. Физиком Клайпероном в 1834г. Он хотя и связал все параметры, характеризующие состояние газа, но это уравнение не удобно для практического применения. Дело в том, что в него, помимо P, V, T входят не измеряемые на опыте число молекул N. В 1874 г. Менделеев усовершенствовал эту формулу, ввел в нее массу:  ,
,  ,
,  Закон Шарля. 1787г. Шарль установил, что давление данной массы газа при постоянном объеме зависит от температуры по линейному закону.
Закон Шарля. 1787г. Шарль установил, что давление данной массы газа при постоянном объеме зависит от температуры по линейному закону.  ,
,  - термический коэффициент давления газа. Тв явл-ся тела, сохраняющие свой объём и форму. Кристаллы – это тв тела, обладающие трёхмерной периодической атомной структурой, называемой кристалл решёткой. Аморфные – тв тела, у которых отсутствует присущая кристалл строгая периодичн по всем направл, это переохл Ж с чрезвычаюно большой вязкостью. Возможность свободного перемещения молекул в жидкости обуславливает текучесть жидкости. Тело в жидком состоянии не имеет постоянной формы. Форма жидкости определяется формой сосуда и силами поверхностного натяжения. Внутри жидкости силы притяжения молекул компенсируются, а у поверхности – нет. Любая молекула, находящаяся у поверхности, притягивается молекулами внутри жидкости. Под действием этих сил молекулы в поверхность втягиваются внутрь до тех пор, пока свободная поверхность не станет минимальной из всех возможных. Т.к. минимальную поверхность при данном объеме имеет шар, то при малом действии других сил поверхность принимает форму сферического сегмента. Поверхность жидкости у края сосуда называется мениском. Явление смачивания характеризуется краевым углом между поверхностью и мениском в точке пересечения. Величина силы поверхностного натяжения на участке длиной Δl равна
- термический коэффициент давления газа. Тв явл-ся тела, сохраняющие свой объём и форму. Кристаллы – это тв тела, обладающие трёхмерной периодической атомной структурой, называемой кристалл решёткой. Аморфные – тв тела, у которых отсутствует присущая кристалл строгая периодичн по всем направл, это переохл Ж с чрезвычаюно большой вязкостью. Возможность свободного перемещения молекул в жидкости обуславливает текучесть жидкости. Тело в жидком состоянии не имеет постоянной формы. Форма жидкости определяется формой сосуда и силами поверхностного натяжения. Внутри жидкости силы притяжения молекул компенсируются, а у поверхности – нет. Любая молекула, находящаяся у поверхности, притягивается молекулами внутри жидкости. Под действием этих сил молекулы в поверхность втягиваются внутрь до тех пор, пока свободная поверхность не станет минимальной из всех возможных. Т.к. минимальную поверхность при данном объеме имеет шар, то при малом действии других сил поверхность принимает форму сферического сегмента. Поверхность жидкости у края сосуда называется мениском. Явление смачивания характеризуется краевым углом между поверхностью и мениском в точке пересечения. Величина силы поверхностного натяжения на участке длиной Δl равна  . Искривление поверхности создает избыточное давление на жидкость, равное при известном краевом угле и радиусе
. Искривление поверхности создает избыточное давление на жидкость, равное при известном краевом угле и радиусе  σ - коэффициент поверхностного натяжения. Капилляром называется трубка с малым внутренним диаметром. При полном смачивании сила поверхностного натяжение направлена вдоль поверхности тела. В этом случае подъем жидк по капилляру продолжается под действием этой силы до тех пор, пока сила тяжести не уравновесит силу поверхностного натяжения F тяж =F нат,т.к.
σ - коэффициент поверхностного натяжения. Капилляром называется трубка с малым внутренним диаметром. При полном смачивании сила поверхностного натяжение направлена вдоль поверхности тела. В этом случае подъем жидк по капилляру продолжается под действием этой силы до тех пор, пока сила тяжести не уравновесит силу поверхностного натяжения F тяж =F нат,т.к.  , то
, то  Испарение — парообразование, происходящее при любой температуре со свободной поверхности жидкости. Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала испарения концентрация вещества в газообразном состоянии достигнет такого значения, при котором число молекул, возвращающихся в жидкость, становится равным числу молекул, покидающих жидкость за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называют насыщенным паром. (Паром называют совокупность молекул, покинувших жидкость в процессе испарения.). Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Давление водяного пара, находящегося в воздухе при данной температуре, называют абсолютной влажностью, или упругостью водяного пара. Абсолютную влажность как плотность водяного пара, находящегося в воздухе при данной температуре, выраженную в килограммах на метр кубический (р). Относительной влажностью называют отношение плотности водяного пара, находящегося в воздухе при данной температуре, к плотности водяного пара при той же температуре, выраженное в процентах, т. е.
Испарение — парообразование, происходящее при любой температуре со свободной поверхности жидкости. Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала испарения концентрация вещества в газообразном состоянии достигнет такого значения, при котором число молекул, возвращающихся в жидкость, становится равным числу молекул, покидающих жидкость за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества. Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называют насыщенным паром. (Паром называют совокупность молекул, покинувших жидкость в процессе испарения.). Так, давление насыщенного пара не зависит от объема, но зависит от температуры. Давление водяного пара, находящегося в воздухе при данной температуре, называют абсолютной влажностью, или упругостью водяного пара. Абсолютную влажность как плотность водяного пара, находящегося в воздухе при данной температуре, выраженную в килограммах на метр кубический (р). Относительной влажностью называют отношение плотности водяного пара, находящегося в воздухе при данной температуре, к плотности водяного пара при той же температуре, выраженное в процентах, т. е.  / Точкой росы называют Т, при которой пар, находящийся в воздухе, становится насыщенным. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара. Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами. 10. Научно-методический анализ и методика изучения законов термодинамики в систематическом курсе физики
/ Точкой росы называют Т, при которой пар, находящийся в воздухе, становится насыщенным. При достижении точки росы в воздухе или на предметах, с которыми он соприкасается, начинается конденсация водяного пара. Для определения влажности воздуха используются приборы, которые называются гигрометрами и психрометрами. 10. Научно-методический анализ и методика изучения законов термодинамики в систематическом курсе физики
|
|
|
|
|
|
|
|
|
|
|
|
В 10 классе углубляется и обобщается понятие внутренней энергии. В современной физике под внутренней энергией понимают сумму энергий хаотического движения и взаимодействия мол-л и энергию движения и взаимодействия частиц, составляющих мол-лу (энергия колебательного движения частиц, энергия электронных оболочек, внутриядерная энергия).
В термодинамике рассматриваются процессы происходящие при не очень ↑Т, поэтому рассматривают изменение внутренней энергии за счет первых двух компонент: U=Ek+Ep.
В 8 классе: кинетическая и потенциальная энергия всех частиц, из кот. состоит тело называется внутренней энергией.
Различия и углубления понятия внутренней энергии идет по пути его применения к идеальному газу U=Ek+Ep.
Рассматривается одноатомный идеальный газ
 p=nkT
p=nkT
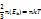

| 

| 
| |

| |||
Для реальных газов, жидкостей и твердых тел Ep¹ 0. для газов  для жидкостей, твердых тел
для жидкостей, твердых тел  Из курса физики 8 класса уч-ся известно, что внутреннюю энергию можно изменить двумя путями: 1. теплопередача (Q – кол-во теплоты – кол-ная мера)
Из курса физики 8 класса уч-ся известно, что внутреннюю энергию можно изменить двумя путями: 1. теплопередача (Q – кол-во теплоты – кол-ная мера)  2. работа (А – работа - кол-ная мера) Работу в термодинамике рассматривают, как правило, на примере работы газа по расширению. Газ находится в сосуде и закрыт невесомым поршнем.
2. работа (А – работа - кол-ная мера) Работу в термодинамике рассматривают, как правило, на примере работы газа по расширению. Газ находится в сосуде и закрыт невесомым поршнем.
|
|
|
Δh- мало Þ p=const
Ar=pS(h2-h1)=p(Sh2-Sh1)
Ar=p(V2-V1)
| Ar=pΔV |
Работа газа положительная если газ расширяется

1-ое нач.ТД: Количество теплоты, сообщаемое системе, расходуется на увеличение её внутренней энергии и на работу совершаемую системой против внешних сил. ∆Q=∆U+Aт.е изменение внутренней энергии равно сумме сообщённого ей количества теплоты и работы, произведённой над системой внешними силами.1-ый з-н ТД является обобщением закона сохранения энергии на совокупность механических и тепловых явлений.Невозможен вечный двигатель 1-ого рода. Применение к изопроцессам: 1)Изотермический – т.к при низкой температуре (∆Т=0) внутренняя энергия газа Uне изменяется (∆U=0), то ∆Q=А. При изотермич. Процессе всё сообщённое газу количество теплоты расходуется на совершение работы.2) Изохорный прцесс, ∆V=0, следовательно ∆Q=∆U, т.е при изохорном процессе всё сообщённое газу кол-во теплоты расходуется на изменение его внутренней энергии.3) Изобарный пр-с: р=const∆Q=∆U+A, при таком процессе кол-во теплоты, сообщённое системе, расходуется на изменение внутренней энергии и на совершение системой работы. ТД -процесс, идущий без обмена теплотой между системой и окружающей средой ∆Q=0, называется адиабатным. 2-ое нач. ТД: невозможен такой циклический процесс, единственным результатом которого было бы превращение теплоты, получаемой системой от внешней среды, в работу дез изменений в окружающей среде. Энтропия характеризует направление процессов в природе. Изменение энтропии в ходе обратимого процесса даётся соотношением: ∆S=∆Q/Т. Все самопроизв. Процессы в любой неравновесной системе происходят в таком направлении, при котором энтропия возрастает до тех пор, пока не достигнет своего максимального значения, соответствующего состоянию теплового равновесия. Тепловой двигатель преобразует внутреннюю энергию системы в механическую работу. КПД –отношение совершаемой двигателем работы А=∆Q1-∆Q2(Q2-кол-во теплоты отданное холл-ку) к полученному от нагревателя ∆Q1.ή=(∆Q1-∆Q2)/ ∆Q1.КПД цикла Карно:.ή=(Т1 –Т2)/ Т1. Цикл Карно сост из 2ух изотерм и 2-ух адиабат.
|
|
|


