 |
В природных водах на их качество.
|
|
|
|
Состав природных вод и методы оценки качества источников водоснабжения
План лекции
1. Характеристика состава вод поверхностных и подземных источников водоснабжения.
2. Влияние различных веществ, содержащихся в водах на их качество.
3. Предельно допустимые концентрации вредных примесей в источниках водоснабжения.
4. Требования к качеству воды.
Характеристика состава вод поверхностных и
Подземных источников водоснабжения.
В качестве источников централизованого водоснабжения используют поверхностные и подземные воды, а в безводных и засушливых районах – атмосферные осадки в виде дождя и снега.
Состав поверхностных вод, рек, озер, водохранилищ, морей определяется климатическими и геоморфологическими факторами, почвенно-геологичес-кими условиями, а также гидромелиоративными мероприятиями.
Соства подземных вод: межпластовых, артезианских, карстовых зависит от условий их формирования.
Состав атмосферных вод, сосредотачиваемых в долинах или искусственных водохранилищах, обусловливается качеством выпавших осадков, чистотой атмосферы, гидрогеологическими особенностями грунтов бассейна сбора воды и способов ее аккумулирования.
В состав воды входят:
1– соли, преимущественно в виде ионов, молекул и комплексов;
2– органические вещества в молекулярных соединениях и в коллоидном состоянии;
3– газы в виде молекул и гидратированных соединений;
4– диспергированные примеси;
5– гидробионты (планктон, бентос, нейстон, пагон), бактерии и вирусы.
Во взешенном состоянии в природных водах содержится гнилистные, песчаные, гипсовые и известковые частицы.
В коллоидном состоянии различные вещества органического происхождения, кремнекислота,гидроксид железа (ІІІ), фульвокислоты, гуматы.
|
|
|
По О.А. Алексину, химический состав природных вод, под которым понимается сложный косплекс минеральных и органических веществ, подразделяется на пять груп:
1. Главные ионы, содержащиеся в наибольшем колличестве Na+, К+, Ca2+, Mg2+, SO42–, карбонаты CO32–, хлориды Cl–, гидрокарбонаты HCO3–.
2. Растворимые газы (N2, O2, CO2, H2S).
3. Биогенные элементы (соединения фосфора, азота, кремния).
4. Микроэлементы – соединения всех остальных химических элементов.
5. Органические соединения.
Размеры взвешенных частиц варьируются то коллоидных до грубодисперсных.
Табл.1.1. сл.1.
Содержание взвешенных частиц в поверхностных водоисточниках изменяется от нескольких единиц до десятков тысяч мг/л. Как правило, южные реки характеризуются большим содержанием взвеси (Аму-Дарья – 12-14 г/л).
Минимальное содержание веществ характерно для северных рек с поверхностным питанием (Нева, Сев. Двина), а максимальное для южных (Кура).
По виду растворенных солей реки подразделяются на несколько классов:
1. Гидрокарбонатные – Волга, Днепр.
2. Сульфатные – Дон, Сев. Денец.
3. Хлоридные – Эмба, Ишим.
Содержание органических солей в разных водах длстигает 150 мг/л и более (северные реки с поверхностным питанием).
В воде озер содержание солей варьируется от 30 (онежское) до 5820 мг/л (Иссык-Куль).
В общем, состав воды водохранилищ зависит от условия формирования и источников питания.
В отличие от поверхностных вод подземные воды характеризуются наибольшим содержанием органических веществ и значительным содержанием минеральных солей, а иносда и растворимых газов (H2S, CO2).
При наличии гидравлической связи между поверхностными и подземными водами последние отличаются повышенной окисляемостью. Подземные воды чпсто характеризуются значительной жесткостью и повышенным содержанием железа.
|
|
|
Л.А. Кульским предложена классификация примесей воды, основанная на их фазовом состояии и дисперсности.
Р.1.1. сл. 2.
Примеси разделяют на четыре группы:
І. Примеси первой группы проникают в воды в следствие эрозии слагающих ложе водоемов пород и смыва с поверхности почв. Это суспензии и эмульсии, а также планктон и бактерии, кинетически устойчивы и находятся во взвешенном состоянии благодаря гидродинамическому воздействию водного потока. В состоянии покоя эти взвеси выпадают в осадок.
ІІ. Примеси второй группы представлят собой гидрофобные и гидрофильные органические и минеральные коллоидные частицы, вымытые водой из грунтов и почв, а также гумусовые вещества и вирусы (двойной электрический слой).
ІІІ. Это молекулярно растворимые вещества (органические вещества, растворимые газы).
IV. Примеси четвертой групы представляют собой вещества, диссоциировавшие на ионы.
Концентрация отдельных примесей в воде определяет ее свойства, т.е. качество воды.
Различают следующие показатели качества воды:
а) физические – температура, взвешенные вещества, цветность, запах, вкус;
б) химический – жесткость, щелочность, активная реакция, окисляемость, сухой остаток;
в) биологические – гидробионты;
г) бактериологические – общее колличество бактерий, колп-индекс.
Влияние различных веществ, содержащихся
в природных водах на их качество.
Для определения качесва воды производят физические, химические, бактериологические, биологические и технологические анализы в наиболее характерные периоды для данного водоисточника. Число и объем анализов качества воды зависит от ее назначения.
Т. 1.2. сл.3.
О качестве природной воды судят на основе ее полоного анализа. Правильность определения солевого состава может быть проверена по равенству суммы главных катионов сумме доминирующих анионов, выраженных в мг/л и пересчитанных в мг-экв/л.
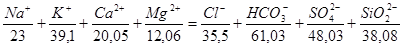

Температура воды подземных источников характеризуется постоянством 8 – 12 0С. Температура воды поверхностных источников меняется по сезонам. Оптимальная температура воды для хозяйствено питьевого водоснабжения 7 – 110С.
Прозрачность, мутность и взвешенные вещества характеризуют наличие в воде суспензированных частиц песка, глины, ила, планктона, водорослей, которые попадают в нее в результате эрозии берегов, с дождевыми и талыми водами. Мутность воды – понятие протовоположное прзрачности, определяют на мутномерах в мг/л путем сравнения образцов вод с имитантами из трепела, каолина или инфузорной земли. Мутность можно определить на ФЭК. По ГОСТ 2874–82 мутность питьевой воды не должна превышать 1,5 мг/л.
|
|
|
Содержание взвешенных частиц определяют путем фильтрования и взвешивания.


 На водоочистных комплексах часто определяют не мутность, а обратную ей величину– прозрачность (ГОСТ 3356–74 "по кресту" и шрифту). По кресту
На водоочистных комплексах часто определяют не мутность, а обратную ей величину– прозрачность (ГОСТ 3356–74 "по кресту" и шрифту). По кресту
– труба 3,5 м Æ 0,03 м – фарфоровый. Нижняя часть подсвечтвается
лампой 300 Вт. Нормой прозрачности питьевой воды является: по кресту – 300 см, по шрифту – 30 см.
Цветность воды обусловлена присутствием гумусовых и дубильных веществ. На окраску так же влияет присутствие железа, сточных вод.
В поверхностных водах с увеличением жесткости, а в гидрокарбонатных – щелочности цветность обычно уменьшается, в то время как мягкие воды с наибольшей щелочностью имебт высокую цветность.
Рис. 1,2. Сл. 4.
Цветность определяют на ФЭК, измеряя оптическую плотность воды.
Привкусы и запахи могут быть естественного (присутствие железа, марганца, H2S) и искусственного происхождения (сброс воды). По ГОСТ 3351–74 различают четыре основных вкуса воды: соленый, горький, сладкий, кислый. Многочисленные оттенки вкусовых ощущуний, складываемых из основных, называются привкусами.
Соленый NaCl; горький – MgSO4; кислый – CO2; щелочной – поташ, сода; вяжущий – CaSO4.
К запахам естественного происхождения относится: землистный, рыбный, гнилостный, сероводородный, ароматический, болотный, глинистный, тинистный. Искусственного происхождения – хлорный, камфорный, аптечный, фенольный.
Интенсивность и характер запахов и привкусов в воде определяется органолептически по 5 – большой шкале.
Т.1,3.сл.5.
Общий, сухой, прокаленный остаток – понятия, позволяющие судить о колличесиве солей и концентрации примесей. Общий или плотный остаток образует содержащие в воде в основном примеси неорганического происхождения (1100С – высушивание). Сухой или растворенный остаток – зарактеризуется содержанием сухих солей или нелетучих органических веществ. Он получается при выпаривании предварительно отфильтрованной воды. Прокаленный остаток – минеральные соли. В питьевой воде не превышает 1г/л.
|
|
|
Хлориды и сульфаты (мг-экв/л или мг/л) благодаря хорошей растворимости присутствуют во всех водах обычно виде натриевых, калиевых, кальциевых солей. Содержание сульфат-ионов в природных водах варьируется 60 – 100 мг/л.
Щелочность воды (мг-экв/л) определяется суммой содержащихся в воде гидроксильных ионов и анионов слабых кислот – угольной, органических. Различают бикарбонатную, карбонатною и гидратную щелочность, которые находят по номограммам. Их сумма обуславливает общую щелочность воды. В процессе обработки почвы могут возникнуть следующие компоненты щелочности.
Т.1.4. сл.6.
Жесткость природных вод вызывается присутствием хорошо растворимых солей ионов Ca2+ и Mg2+, жесткость воды не является вредной для здоровья человека, а скорее наоборот. Кальций способствуев выведению из организма кадмия, отрицательно ввлияющего на сердечно-сосудистую систему.
Железо и марганец присутствуют в водах в формах, зависящих от рН (Fe+2, Fe+3).
Активная реакция воды является показателем ее щелочности или кислотности. Колличесивенно она характеризуется концентрацией водородных ионов. На практике концентрация водородных ионов выражается показателем рН.
Активная концентрация природных вод обычно варьируется в пределах рН 6,5 – 8,5, что соответствует лимитам питьевой воды.
Растворимые в воде газы – O2, CO2, H2S, СН4, N2 имеют значение для оценки ее качества; так CO2, H2S обуславливают коррозионные свойства воды по отношению к металлам и бетонам. Углекислота содержится во всех природных водах от нескольких мг/л (поверхностные воды) до сотен мг/л (подземные воды).
В заввисимости от рН воды углекислота присутствует в ней в виде свободной углекислоты (растворимая CO2), полусвязанной углекислоты HCO3– (бикарбонат-ион) и связанной CO32– (карбонат-ион).
Гидробтонты – населяющие природные воды. Они подразделяются на:
– плангтон – обитатели, пребывающие в толще воды от дна до поверхности;
– бентос – обитатели, находящиеся на дне водоема;
– нейстон – организмы, населяющие поверхностную пленку воды;
– пагон – молуски, ракообразные.
Бактерии, вирусы по типу питания разделяет на три групы:
1) аутотрофные – энергию получают при фотосинтезе;
|
|
|
2) гетеротрофные (сапрофиты) – для питания используют готовые органические вещества;
3) паротрофные (паразиты).
На Т. 1.8. сл. 7. показаны сроки существования отдельных микробов.
|
|
|


