 |
Урок «жидкие вещества. Вода»
|
|
|
|
Урок «ЖИДКИЕ ВЕЩЕСТВА. ВОДА»
Вода H2O (Оксид водорода) - самое распространённое в природе химическое соединение.
Запасы воды на Земле: в морях и океанах - 1,4 млрд. км3; в ледниках - 30 млн. км3; в реках и озёрах - 2 млн. км3; в атмосфере - 14 тыс. км3; в живых организмах - 65%
Молекула воды полярная; угол- 104,5° 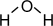 ; связь O–H ковалентная полярная.
; связь O–H ковалентная полярная.
Вода является дипольным растворителем (растворяет многие газы, жидкие и твёрдые вещества). Между молекулами воды - водородные связи: 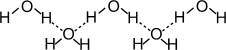
Аномалии воды:
1. Лёд плавает на поверхности водоёма, р(льда) = 0,92 г/см3, рmax (воды при +4°С)= 1г/см3 При замерзании воды происходит расширение объёма.
2. Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород). При нагревании любого вещества теплоемкость неизменно повышается. Вода – исключение: с повышением температуры изменение теплоемкости воды аномально: от 0 до 370С она понижается и только от 37 до 1000С теплоемкость все время растет.
3. Исключительно высокое поверхностное натяжение. Из всех известных жидкостей только ртуть имеет более высокое поверхностное натяжение. Это свойство проявляется в том, что вода всегда стремится сократить свою поверхность.
Химические свойства воды:
1. Кислотно-основные свойства:
Слабый электролит: H2O ⇌ H+ + OH-
v Вода – амфотерное вещество. Она реагирует как с основными оксидами (оксидами щелочных и щелочноземельных металлов), так и с кислотными оксидами (кроме SiO2):
Li2O + H2O= 2LiOH; MgO + H2O= Mg(OH)2; SO3 + H2O= H2SO4
v Гидролиз некоторых солей приводит к их полному разложению:
Al2S3 + 6H2O= 2Al(OH)3 + 3H2S; Al2(CO3)3 + 6H2O= 2Al(OH)3 + 3H2O + 3CO2
v Вода разлагает гидриды, фосфиды, карбиды, нитриды и некоторые другие бинарные соединения активных металлов с неметаллами:
|
|
|
CaH2 + 2H2O= Ca(OH)2 + 2H2
Ca3P2 + 6H2O=3Ca(OH)2 + 2PH3
Al4C3 + 12H2O= 4Al(OH)3 + 3CH4 (так же гидролизуется и карбид бериллия Ве2С)
CaC2 + 2H2O= Ca(OH)2 + C2H2 (так же гидролизуется и карбид магния составаMgC2)
Mg2C3 + 4H2O= 2Mg(OH)2+ НС≡С–СН3
Ca3N2 + 6H2O= 3Ca(OH)2 + 2NH3
v Молекулы воды с некоторыми солями дают кристаллогидраты:
CuSO4(белый) + 5H2O= CuSO4 *5H2O(синий)
2. Окислительно-восстановительные свойства:
1. С активными металлами (стоящими в ряду напряжений металлов до Mg включительно) образуется щёлочь и водород, а с металлами средней активности (стоящими в ряду напряжений металлов от Mg до Pb при нагревании) - оксид и водород:
2Na + 2H2O= 2NaOH + H2; Ca + 2H2O= Ca(OH)2 + H2 ; 3Fe + 4H2O = Fe3O4 + 4H2
2. С галогенами (продукты различны): 4F2 + 3H2O= OF2+ 6HF + O2; Cl2 + H2O= HClO + HCl
3. С некоторыми неметаллами: C + H2O = H2 + CO
4. Электролиз воды: 2Н2О= 2Н2+О2
Вода, в состав которой входит изотоп водорода дейтерий, называется тяжёлой водой D2O
Химические реакции с тяжёлой водой протекают медленнее, чем с обычной водой. Поэтому D2O накапливается при длительном электролизе H2O
Домашнее задание: § 9 до стр.82; конспект урока в тетради
Урок «ЖИДКИЕ ВЕЩЕСТВА. ВОДА»
Вода H2O (Оксид водорода) - самое распространённое в природе химическое соединение.
Запасы воды на Земле: в морях и океанах - 1,4 млрд. км3; в ледниках - 30 млн. км3; в реках и озёрах - 2 млн. км3; в атмосфере - 14 тыс. км3; в живых организмах - 65%
Молекула воды полярная; угол- 104,5° 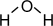 ; связь O–H ковалентная полярная.
; связь O–H ковалентная полярная.
Вода является дипольным растворителем (растворяет многие газы, жидкие и твёрдые вещества). Между молекулами воды - водородные связи: 
Аномалии воды:
1. Лёд плавает на поверхности водоёма, р(льда) = 0,92 г/см3, рmax (воды при +4°С)= 1г/см3 При замерзании воды происходит расширение объёма.
2. Самая большая теплоёмкость (в 3100 раз больше, чем у воздуха; в 4 раза больше, чем у горных пород). При нагревании любого вещества теплоемкость неизменно повышается. Вода – исключение: с повышением температуры изменение теплоемкости воды аномально: от 0 до 370С она понижается и только от 37 до 1000С теплоемкость все время растет.
|
|
|
3. Исключительно высокое поверхностное натяжение. Из всех известных жидкостей только ртуть имеет более высокое поверхностное натяжение. Это свойство проявляется в том, что вода всегда стремится сократить свою поверхность.
Химические свойства воды:
1. Кислотно-основные свойства:
Слабый электролит: H2O ⇌ H+ + OH-
v Вода – амфотерное вещество. Она реагирует как с основными оксидами (оксидами щелочных и щелочноземельных металлов), так и с кислотными оксидами (кроме SiO2):
Li2O + H2O= 2LiOH; MgO + H2O= Mg(OH)2; SO3 + H2O= H2SO4
v Гидролиз некоторых солей приводит к их полному разложению:
Al2S3 + 6H2O= 2Al(OH)3 + 3H2S; Al2(CO3)3 + 6H2O= 2Al(OH)3 + 3H2O + 3CO2
v Вода разлагает гидриды, фосфиды, карбиды, нитриды и некоторые другие бинарные соединения активных металлов с неметаллами:
CaH2 + 2H2O= Ca(OH)2 + 2H2
Ca3P2 + 6H2O=3Ca(OH)2 + 2PH3
Al4C3 + 12H2O= 4Al(OH)3 + 3CH4 (так же гидролизуется и карбид бериллия Ве2С)
CaC2 + 2H2O= Ca(OH)2 + C2H2 (так же гидролизуется и карбид магния составаMgC2)
Mg2C3 + 4H2O= 2Mg(OH)2+ НС≡С–СН3
Ca3N2 + 6H2O= 3Ca(OH)2 + 2NH3
v Молекулы воды с некоторыми солями дают кристаллогидраты:
CuSO4(белый) + 5H2O= CuSO4 *5H2O(синий)
2. Окислительно-восстановительные свойства:
1. С активными металлами (стоящими в ряду напряжений металлов до Mg включительно) образуется щёлочь и водород, а с металлами средней активности (стоящими в ряду напряжений металлов от Mg до Pb при нагревании) - оксид и водород:
2Na + 2H2O= 2NaOH + H2; Ca + 2H2O= Ca(OH)2 + H2 ; 3Fe + 4H2O = Fe3O4 + 4H2
2. С галогенами (продукты различны): 4F2 + 3H2O= OF2+ 6HF + O2; Cl2 + H2O= HClO + HCl
3. С некоторыми неметаллами: C + H2O = H2 + CO
4. Электролиз воды: 2Н2О= 2Н2+О2
Вода, в состав которой входит изотоп водорода дейтерий, называется тяжёлой водой D2O
Химические реакции с тяжёлой водой протекают медленнее, чем с обычной водой. Поэтому D2O накапливается при длительном электролизе H2O
Домашнее задание: § 9 до стр.82; конспект урока в тетради
|
|
|


