 |
Определение содержания гидроксида натрия в анализируемом растворе
|
|
|
|
Кафедра химии
КИСЛОТНО-ОСНОВНОЕ ТИТРОВАНИЕ
Лабораторные работы № 1 – 7
по дисциплине «Аналитическая химия»
Специальность _____________________________________________________
Специализация _____________________________________________________
| Проверил | Выполнил |
| _____________________________ | студент группы ____________ |
| __________________________ | |
| «_____» ________________ 2013 г | «_____» ______________ 2013 г |
Могилев 2013
Лабораторная работа № 1
Приготовление рабочего раствора соляной кислоты
1.1 Цель работы: освоить расчет и методику приготовления рабочего раствора соляной кислоты заданной концентрации путем разбавления более концентрированного раствора.
Приборы и реактивы
Мерный цилиндр вместимостью 10 мл, склянка для хранения раствора вместимостью 500 мл, концентрированный 36% раствор соляной кислоты.
Порядок выполнения работы
Рабочий раствор 0,1 н соляной кислоты готовят разбавлением концентрированного 36 % раствора (ρ = 1,174 г/мл).
Расчет: При разбавлении раствора масса растворенного вещества остается постоянной. Найдем массу чистой соляной кислоты, необходимую для приготовления 500 мл 0,1н раствора:

Найдем объем 36% раствора, который содержит такую же массу соляной кислоты:
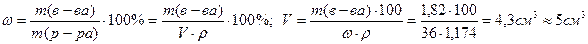
Для приготовления 500 см3 0,1н раствора соляной кислоты необходимо взять 5 мл концентрированного раствора.
Приготовление раствора. Мерным цилиндром (в вытяжном шкафу) отбирают 5 мл 36 % раствора соляной кислоты, переносят в склянку и разбавляют дистиллированной водой до объема 500 мл. На склянку приклеивают этикетку с указанием названия и концентрации раствора, фамилии студента, номера группы, даты приготовления.
Результаты работы
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
|
|
|
Лабораторная работа № 2
Определение концентрации раствора соляной кислоты (стандартизация) по стандартному раствору тетрабората натрия.
2.1 Цель работы: освоить технику титрования, овладеть методикой кислотно-основного титрования, определить концентрацию соляной кислоты по стандартному раствору тетрабората натрия.
2.2 Приборы и реактивы: бюретка вместимостью 50 мл, колба для титрования, пипетка Мора вместимостью 10, 15 или 20 мл, химический стакан вместимостью 250 мл, рабочий раствор соляной кислоты, стандартный раствор тетрабората натрия, раствор индикатора метилового красного.
Порядок выполнения работы
Перед началом работы следует внимательно изучить правила пользования бюреткой и правила титрования (см. приложение).
Титрование тетрабората натрия соляной кислотой можно представить следующим уравнением:
Na2B4O7 + 2HCl +5H2O → 2NaCl + 4H3BO3
2Na+ + B4O72– + 2H+ + 2Cl– +5H2O → 2Na+ + 2Cl– +4H3BO3
B4O72– + 2H+ +5H2O → 4H3BO3
Тетраборат натрия – это соль, образованная катионом сильного основания и анионом слабой кислоты, поэтому ее раствор имеет сильно щелочную реакцию. Титрование ведут в присутствии индикатора метилового красного, интервал перехода которого 4,4 – 6,2.
Бюретку укрепляют в штативе в строго вертикальном положении, сливают дистиллированную воду и споласкивают рабочим раствором соляной кислоты. Затем бюретку наполняют раствором соляной кислоты выше нулевой отметки, заполняют носик раствором и устанавливают уровень кислоты на нулевое деление, сливая избыток кислоты в стакан.
Тщательно вымытую пипетку дважды ополаскивают приготовленным стандартным раствором буры и переносят в чистую колбу для титрования. Добавляют 2–3 капли индикатора метилового-красного (раствор приобретает бледно-желтую окраску).
|
|
|
В колбу для титрования прибавляют по несколько капель соляной кислоты из бюретки, непрерывно перемешивая жидкость плавными круговыми движениями. Титрование продолжают до перехода окраски раствора из желтой в бледно-розовую от одной капли. Титрование повторяют 3–5 раз, расхождение в результатах не должно превышать 0,05 мл. После каждого титрования оттитрованный раствор выливают, колбу ополаскивают дистиллированной водой и набирают новую аликвотную часть. Полученные результаты титрования заносят в таблицу 2.1:
Таблица 2.1 – Результаты титрования тетрабората натрия соляной кислотой
| № титрования | V (Na2B4O7), мл | V( HCl), пошедший на титрование, мл | V (HCl)ср, мл |
Расчет среднего объема, пошедшего на титрование, проводят по уравнению6:
 6
6
где V1, V2, V3, Vn – объемы титранта, пошедшие на титрование, n – число полученных объемов.
_____________________________________________________________________________________
По закону эквивалентов рассчитывается нормальная концентрация соляной кислоты:
С н(HCl) · V (HCl) = С н(Na2B4O7) · V (Na2B4O7),
 =
=
Полученное значение концентрации соляной кислоты записывают в рабочий журнал и на этикетку склянки для хранения HCl.
2.4 Результаты работы:
__________________________________________________________________________________________________________________________________________________________________________
Лабораторная работа № 3
Определение содержания гидроксида натрия в анализируемом растворе
3.1 Цель работы: определение массы гидроксида натрия в анализируемом растворе (ω, г).
3.2 Приборы и реактивы: бюретка вместимостью 50 мл, мерная колба вместимостью 100 мл, колба для титрования, пипетка Мора вместимостью 10, 15 или 20 мл, химический стакан, стандартизированный раствор соляной кислоты, анализируемый раствор гидроксида натрия, раствор индикатора метилового красного.
Порядок выполнения работы
Титрование соляной кислотой гидроксида натрия можно представить следующим уравнением:
NaOH + HCl → NaCl + H2O
Na+ + OH– + H+ + Cl– → Na+ + Cl– + H2O
OH– + H+ → H2O
В мерную колбу объемом 100 мл в соответствии с вариантом набирают задачу на NaOH и доводят до метки дистиллированной водой. Колбу закрывают пробкой и тщательно перемешивают.
|
|
|
Подготовленную к работе бюретку (см. приложение) заполняют стандартизированным раствором соляной кислоты. Пипетку ополаскивают раствором гидроксида натрия. В колбу для титрования отмеряют пипеткой аликвотную часть анализируемого раствора NaOH, добавляют 2–3 капли индикатора метилового красного и титруют раствором соляной кислоты. Титрование продолжают до перехода окраски раствора из желтой в бледно-розовую от одной капли. Титрование продолжают 3–5 раз. Полученные результаты заносят в таблицу 3.1
Таблица 3.1 – Результаты титрования гидроксида натрия соляной кислотой
| № титрования | V (NaOH), мл | V (HCl), пошедший на титрование, мл | V (HCl)ср, мл |
По полученным данным рассчитывают процентную концентрацию гидроксида натрия и по уравнению 7 находят массу гидроксида натрия в анализируемом растворе:
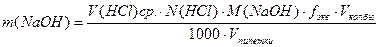 7
7
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Результаты работы
__________________________________________________________________________________________________________________________________________________________________________
Список литературы
1.Общие требования и правила оформления текстовых документов: СТП 15-06-2004. – Введ. 30.11.04. – Могилев: Могилевский государственный университет продовольствия, 2004. – 41 с.
2.Методические указания по курсу аналитическая химия: Задачи по количественному анализу, часть 2, для студентов технологических специальностей / Могилевский технологический институт; сост. О.Г. Поляченок, Е.А. Трилинская. – Могилев, 1997. – 39 с.
3.Алексеев, В.Н. Количественный анализ / В.Н. Алексеев. – М.: Химия. – 1972. – 504 с.
4.Васильев, В.П. Аналитическая химия в 2 ч. – Ч. 1: Гравиметрический и титриметрический методы анализа / В.П. Алексеев. – М.: Высшая школа. – 1989. – 320 с.
5.Коренман, Я.И. Практикум по аналитической химии / Я.И. Коренман, Р.П. Лисицкая. – Воронеж: Воронеж. гос. технол. акад. – 2002. – 408 с.
Правила титрования
|
|
|
1. При анализе пользоваться только чистой посудой. Жидкость при выливании из бюретки и пипетки не должна оставлять капель на стенках.
2. Перед употреблением бюретку необходимо ополоснуть раствором, которым будете титровать (титрантом).
3. Пипетку ополаскивают титруемым раствором. Для этого сначала небольшим количеством раствора ополаскивают стакан, наливают в стакан еще немного раствора, которым ополаскивают внутри и снаружи пипетку.
4. Бюретка должна быть установлена строго вертикально.
5. Раствор в бюретку заливают через воронку, которую сразу же удаляют.
6. Удаляют пузырьки воздуха из носика бюретки. Для этого приподнимают носик бюретки, направляя его в стакан, и открывают зажим.
7. Перед каждым титрованием бюретку заполняют титрантом на 5 мл выше нулевого уровня, ждут одну минуту, чтобы дать стечь раствору со стенок бюретки.
8. Доводят уровень жидкости до нуля. Отсчет по бюретки производят по нижнему краю мениска для неокрашенных и слабоокрашенных жидкостей, и по верхнему краю мениска для сильноокрашенных жидкостей.
9. При отсчете по бюретке глаза должны находится на уровне мениска. Отсчет следует производить с точностью до сотых долей миллилитра через 30 с после окончания титрования.
10. При титровании необходимо сливать жидкость с такой скоростью, чтобы можно было считать капли.
11. Жидкость в пипетку набирают выше метки примерно на 2 см и быстро закрывают указательным пальцем. Чуть приоткрывая отверстие пипетки, дают жидкости стечь до тех пор, пока нижний край мениска не совпадет с отметкой. Кончиком пипетки касаются стенок сосуда, чтобы снять последнюю каплю. Раствор из пипетки переносят в колбу, жидкости дают свободно стечь. Затем касаются кончиком пипетки стенки или дна колбы и ждут 10–20 секунд. Выдувать последнюю каплю нельзя.
12. При титровании подачу раствора регулируют левой рукой, раствор в колбе аккуратно перемешивают правой рукой.
13. Для получения правильного результата титрование повторяют не менее трех раз. Разница между параллельными результатами не должна превышать 0,05 мл. При дальнейших расчетах пользуются средним значением.
14. Каждое последующее титрование начинают от нуля.
15. После окончания титрования бюретку следует вымыть и оставить заполненной дистиллированной водой.
|
|
|


