 |
Неорганическая химия. Элементы и их соединения
|
|
|
|
Водород
Электронная конфигурация 1s1
Степени окисления 1,0, −1
Получение:
В промышленности
1.Электролиз водных растворов солей:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2
2.Пропускание паров воды над раскаленным коксом при температуре около 1000 °C:
H2O + C ⇄ H2 + CO
3.Из природного газа.
Конверсия с водяным паром:
CH4 + H2O ⇄ CO + 3H2 (1000 °C)
Каталитическое окисление кислородом:
2CH4 + O2 ⇄ 2CO + 4H2
4. Крекинг и риформинг углеводородов в процессе переработки нефти.
В лаборатории
1. Действие разбавленных кислот на металлы. Для проведения такой реакции чаще всего используют цинк и разбавленную соляную кислоту:
Zn + 2HCl → ZnCl2 + H2↑
2. Взаимодействие кальция с водой:
Ca + 2H2O → Ca(OH)2 + H2↑
3. Гидролиз гидридов:
NaH + H2O → NaOH + H2↑
4. Действие щелочей на цинк или алюминий:
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2↑
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2↑
5. С помощью электролиза. При электролизе водных растворов щелочей или кислот на катоде происходит выделение водорода, например:
2H3O+ + 2e- → H2↑ + 2H2O
Химические свойства

Молекулы водорода Н2 довольно прочны, и для того, чтобы водород мог вступить в реакцию, должна быть затрачена большая энергия:
Н2 = 2Н − 432 кДж
Поэтому при обычных температурах водород реагирует только с очень активными металлами, например с кальцием, образуя гидрид кальция:
Ca + Н2 = СаН2
и с единственным неметаллом — фтором, образуя фтороводород:
F2 + H2 = 2HF
С большинством же металлов и неметаллов водород реагирует при повышенной температуре или при другом воздействии, например при освещении:
О2 + 2Н2 = 2Н2О
Он может «отнимать» кислород от некоторых оксидов, например:
CuO + Н2 = Cu + Н2O
Записанное уравнение отражает восстановительные свойства водорода.
|
|
|
N2 + 3H2 → 2NH3
С галогенами образует галогеноводороды:
F2 + H2 → 2HF, реакция протекает со взрывом в темноте и при любой температуре,
Cl2 + H2 → 2HCl, реакция протекает со взрывом, только на свету.
С сажей взаимодействует при сильном нагревании:
C + 2H2 → CH4
Взаимодействие со щелочными и щёлочноземельными металлами
При взаимодействии с активными металлами водород образует гидриды:
2Na + H2 → 2NaH
Ca + H2 → CaH2
Mg + H2 → MgH2
Гидриды — солеобразные, твёрдые вещества, легко гидролизуются:
CaH2 + 2H2O → Ca(OH)2 + 2H2↑
Взаимодействие с оксидами металлов (как правило, d-элементов)
Оксиды восстанавливаются до металлов:
CuO + H2 → Cu + H2O
Fe2O3 + 3H2 → 2Fe + 3H2O
WO3 + 3H2 → W + 3H2O
Гидридные комплексы содержат в качестве лиганда гидридный ион Н-. Комплексообразователи в гидридных комплексах чаще всего элементы IIIA-группы – бор, алюминий, галлий, индий, таллий. В ряду [BH4]- > [AlH4]- > [GaH4]- устойчивость гидридных комплексов падает.
Гидридные комплексы – сильнейшие восстановители. Под действием кислот и в водной среде они разлагаются, выделяя водород:
Na[AlH4] + 4 H2O = NaOH + Al(OH)3 + 4 H2
2 Na[BH4] + H2SO4 = Na2SO4 + B2H6 + 2 H2
Для синтеза гидридных комплексов используют реакции:
4 NaH + B(OCH3)3 == Na[BH4] + 3 CH3ONa (при 250 °C)
4 LiH + AlCl3 = Li[AlH4] + 3 LiCl
3 Li[BH4] + AlCl3 = Al[BH4]3 + 3 LiCl
NaBO2 + Al + Na + 2 H2 = Na[BH4] + NaAlO2
Последнюю из указанных реакций ведут в автоклаве под давлением 5-10 атм.
Тетрагидридоборат алюминия Al[BH4]3 – самое летучее из всех известных соединений алюминия (температура кипения Al[BH4]3 равна 44,5 °С); на воздухе самовоспламеняется, а с водой энергично взаимодействует:
Al[BH4]3 + 12 H2O = 3B(OH)3 + Al(OH)3 + 12 H2
Гидриды — соединения водорода и элементов с меньшей электроотрицательностью, чем у водорода. Так, например, соединения водорода с галогенами, азотом, кислородом, углеродом, сурьмой, полонием и серой не являются гидридами.
Классификация
В зависимости от характера связи водорода различают три типа гидридов:
|
|
|
- ионные гидриды (солеобразные гидриды);
- металлические гидриды;
- ковалентные гидриды.
Примеры
- Гидрид натрия NaH
- Гидрид кальция CaH2
- Силан SiH4
- Герман GeH4
63.
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода
Н3РО4  Н+ + Н2РО-4(первая ступень)
Н+ + Н2РО-4(первая ступень)
Н2РО-4  Н+ + НРO2-4 (вторая ступень)
Н+ + НРO2-4 (вторая ступень)
НРО2-4  Н+ PОЗ-4 (третья ступень)
Н+ PОЗ-4 (третья ступень)
Диссоциация многоосновной кислоты протекает главным образом по первой ступени, в меньшей степени по второй и лишь в незначительной степени - по третьей. Поэтому в водном растворе, например, фосфорной кислоты наряду с молекулами Н3РО4 имеются ионы (в последовательно уменьшающихся количествах) Н2РО2-4, НРО2-4 и РО3-4.
Примеры расчета
(A — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы НА):
Одноосновная кислота
HA = H + + A −

Двухосновная кислота
H 2 A = H + + HA −

HA − = H + + A 2 −

Следует понимать, что фигурирующая в выражениях концентрация HA — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
64.
| Строение внешней и предвнешней электронных оболочек атома | Cu | Ag | Au |
| 3s2p6d104s1 | 4s2p6d105s1 | 5s2p6d106s1 |
В атомах элементов Сu, Ag, Au происходит «провал» s- электрона, приводящий к полному заполнению электронами d- орбиталей. Благодаря наличию одного s-электрона во внешнем слое для этих элементов характерна степень окисления +1.
В образовании химических связей могут принимать участие также электроны с d- оболочки, поэтому медь проявляет устойчивую степень окисления +2, а золото +3.
Исключение представляет взаимодействие меди с очень конц. НCl, так как в результате комплексообразования потенциал меди значительно сдвигается в область отрицательных значений:
2Сu + 4НCl ® 2Н[CuCl2] + H2
Аналогичный окислительно-восстановительный процесс, обусловленный комплексообразованием, протекает в растворах цианидов:
2Сu + 4KCN + 2H2O ® 2K[Cu(CN)2] + 2КОН + Н2
Медь и серебро легко окисляются азотной кислотой:
3Сu + 8НNO3(разб.) ® 3Cu(NO3)2 + 2NO + 4H2O
Ag + 2HNO3(конц.) ® AgNO3 + NO2 + H2O
3олото реагирует с селеновой кислотой:
2Au + 6H2SeO4 ® Au2(SeO4)3 + 3H2SeO3 + 3H2O
В азотной кислоте золото не растворяется, но быстро взаимодействует с царской водкой
|
|
|
Для элементов подгруппы 1Б, как и других побочных подгрупп, наблюдается стабилизация высших степеней окисления с увеличением их порядкового номера. Ионы Au+ в водных растворах диспропорционируют на Au0 и Au+3; в водной среде Au+ существует только в виде прочных комплексов, например [Au(CN)2]–.
Оба оксида меди Сu2O и СuО не взаимодействуют с водой. С кислотами реагируют с образованием солей Сu+ и Сu+2. Легко растворяются в водном растворе NH3 с образованием комплексных соединений:
Сu2O + 4NH3 + H2O ® 2[Cu(NH3)2]OH (бесцветный)
CuO + 4NH3 + H2O ® [Cu(NH3)4](OH)2 (темно-синий)
Эта реакция обусловлена неустойчивостью Cuh, который сразу разлагается. Нестоек также цианид меди(II) Cu(CN)2, поэтому при действии цианидов на растворы солей Сu+2 образуется CuCN (осадок) и дициан C2N2. Осадок CuI растворяется при действии Na2S2O3:
CuI + 2Na2S2O3 ® Na3[Сu(S2O3)2] + NaI
Растворимость галогенидов AgГ уменьшается при переходе от AgF к AgI. Фторид серебра AgF (белый) хорошо растворим в воде, a AgCl (белый),
AgBr (желтоватый), AgI (желтый) выпадают в осадок при взаимодействии с водном растворе Ag+ с F–. Хлорид серебра растворяетется в водном аммиаке с образованием амминкомплекса:
AgCl + 2NH3 ® [Ag(NH3)2]Cl
Аналогичная реакция происходит с AgBr, но не идет с AgI,, так как эта соль очень мало растворима (ПР = 8,5·10–17)
Все галогениды серебра растворяются в растворе Na2S2O3
AgГ + 2Na2S2O3 ® Na3[Ag(S2O3)2] +NaГ
При растворении AuCl3 в воде образуется гидроксотри-хлороаурат(III) водорода:
AuCl3 + H2O ® H[Au(OH)Cl3]
Пентафторид AuF проявляет кислотные свойства, с основными фторидами образует фтороаураты (V), например:
NaF + AuF = Na[AuF]
Серебро, будучи благородным металлом, отличается относительно низкой реакционной способностью, оно не растворяется в соляной и разбавленной серной кислотах. Однако в окислительной среде (в азотной, горячей концентрированной серной кислоте, а также в соляной кислоте в присутствии свободного кислорода) серебро растворяется:
Ag + 2HNO3(конц.) = AgNO3 + NO2↑ + H2O

65.

При сравнении окислительной способности вещества всегда нужно учитывать реальные условия протекания процессов. Например, утверждение, что в ряду кислот НClO –НClO2 — НClO3 — НClO4 окислительная активность уменьшается от НClО к НClO4, верно только для обычных условий (комнатная температура, действие света). Здесь решающее значение имеет не окислительная способность хлора в положительной степени окисления, а атомарный кислород, выделяющийся при распаде неустойчивых кислот, устойчивость которых на свету как раз возрастает от НClО к НСlO4. Если же сравнивать окислительную способность этих кислот в других условиях — в темноте, при более низких температурах, то окислительная способность возрастает от НClО к НClО4.
|
|
|
Химия
НЕОРГАНИЧЕСКАЯ ХИМИЯ. ЭЛЕМЕНТЫ И ИХ СОЕДИНЕНИЯ
Галогены
Свойства элементов VII A группы.
| Свойства | 9F | 17Cl | 35Br | 53I | 85At |
| Атомная масса | 18,998 | 35,453 | 79,909 | 126,904 | [210] |
| Электронная конфигурация* | 
| 
| 
| 
| 
|

| 0,071 | 0,99 | 0,114 | 0,133 | - |

| 0,133 | 0,181 | 0,196 | 0,220 | 0,230 |
Энергия ионизации

| 17,43 | 13,01 | 11,84 | 10,45 | 9,50 |
| Относительная электроотри- цательность | 4,00 | 3,00 | 2,80 | 2,60 | 2,20 |
| Возможные степени окисления | -1 | -1, +1, +3, +5, +7 | |||
| кларк, ат.% (распространненость в природе) | 0,02 | 0,02 | 3*10-5 | 4*10-6 | следы |
| Агрегатное состояние (н. у.), цвет | газ сетло-зеленый | газ желто-зеленый | жидкость красно-коричневая | тв. вещество черно-фиолетовое | тв. вещество |

| -223 | -100,98 | -7,2 | 311,5 | |

| -187 | -34,5 | 58,75 | 184,5 | |
Плотность 
| 1,108 ж. | 1,57 ж. | 3,187 | 4,942 | - |
Стандартный электродный потенциал

| 2,87 | 1,36 | 1,07 | 0,54 | - |
*Приведены конфигурации внешних электронных уровней атомов соответствующих элементов. Конфигурации остальных электронных уровней совпадают с таковыми для благородных газов, завершающих предыдущий период и указанных в скобках.
Электронные конфигурации внешнего валентного слоя галогенов относятся к типу ns2np5 (n == 2, 3, 4 и 5 соответственно у фтора, хлора, брома и иода). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов — способностью присоединять электроны обладают все галогены, хотя при переходе к иоду окислительная способность галогенов ослабляется.
При обычных условиях галогены существуют в виде простых веществ, состоящих из двухатомных молекул типа Hal2 с ковалентными связями.
Физические свойства галогенов существенно различаются: при нормальных условиях фтор — газ, который трудно сжижается, хлор — также газ, но сжижается легко, бром — жидкость, иод — твердое вещество.
Химические свойства. В отличие от всех других галогенов фтор во всех своих соединениях проявляет только одну степень окисления 1- и не проявляет переменной валентности. Для других галогенов наиболее характерной степенью окисления также является 1-, однако, благодаря наличию свободных d-орбиталей на внешнем уровне они могут проявлять и другие нечетные степени окисления от 1+ до 7+ за счет частичного или полного распаривания валентных электронов.
|
|
|
Наибольшей активностью обладает фтор. Большинство металлов даже при комнатной температуре загорается в его атмосфере, выделяя большое количество теплоты, например:

Без нагревания фтор реагирует и со многими неметаллами (водородом, S, С, Si, P), выделяя при этом также большое количество теплоты:

При нагревании фтор окисляет все другие галогеныпо схеме:

где Hal = Cl, Br, I, причем в соединениях HalF степени окисления хлора, брома и иода равны 1+.
Наконец, при облучении фтор реагирует даже с инертными газами:

Взаимодействие фтора со сложными веществами также протекает очень энергично. Он окисляет воду, при этом реакция носит взрывной характер:
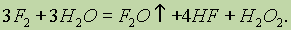
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов, например:

Для этих реакций, как и для всех других, очень важны условия их протекания. Так, при комнатной температуре хлор с водородом не реагирует; при нагревании эта реакция протекает, но оказывается сильно обратимой, а при мощном облучении протекает необратимо (со взрывом) по цепному механизму.
Хлор вступает в реакции со многими сложными веществами, например замещения и присоединения с углеводородами:

Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:

а также обратимо реагирует с водой:

Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала1- (в НС1), у других1+ (в хлорноватистой кислоте НОС1). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами.
Химическая активность брома меньше, чем фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора. Являясь более “мягким” реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же как и хлор, растворяется в воде и, частично реагируя с ней, образует так называемую “бромную воду”, тогда как иод практически в воде нерастворим и не способен ее окислять даже при нагревании; по этой причине не существует “йодной воды”.
Получение галогенов. Наиболее распространенным технологическим методом получения фтора и хлора является электролиз расплавов их солей. Бром и иод в промышленности, как правило, получают химическим способом.
В лаборатории хлор получают действием различных окислителей на соляную кислоту, например:

Еще более эффективно окисление проводится перманганатом калия.
Галогеноводороды. Все галогеноводороды при обычных условиях газообразны. Химическая связь, осуществляемаяв их молекулах, — ковалентная полярная, причем полярность связи в ряду HF — НС1 — HBr — HI падает. Прочность связи также уменьшается в этом ряду. Вследствие своей полярности все галогеноводороды, в отличие от галогенов, хорошо растворимы в воде. Так, при комнатной температуре в 1 объеме воды можно растворить около 400 объемов НСl, 530 объемов HBr и около 400 объемов HI.
При растворении галогеноводородов в воде происходит их диссоциация на ионы и образуются растворы соответствующих галогеноводородных кислот. Причем при растворении HI, HBr и НС1 диссоциируют почти полностью, поэтому образующиеся кислоты относятся к числу сильных. В отличие от них фтороводородная (плавиковая) кислота является слабой. Это объясняется ассоциацией молекул HF вследствие возникновения между ними водородных связей. Таким образом, сила кислот уменьшается от HI к НF.
Поскольку отрицательные ионы галогеноводородных кислот могут проявлять только восстановительные свойства, то при взаимодействии этих кислот с металлами окисление последних может происходить только за счет ионов Н+. Поэтому кислоты HHal реагируют только с металлами, стоящими в ряду напряжений левее водорода.
Все галогениды металлов, за исключением солей Ag и РЬ, хорошо растворимы в воде. Малая растворимость галогенидов серебра позволяет использовать обменную реакцию типа

как качественную для обнаружения соответствующих ионов. В результате реакции AgCl выпадает в виде осадка белого цвета, AgBr — желтовато-белого, AgI — ярко-желтого цвета.
В отличие от других галогеноводородных кислот плавиковая кислота взаимодействует с оксидом кремния (IV):

Так как оксид кремния входит в состав стекла, то плавиковая кислота разъедает стекло, и поэтому в лабораториях ее хранят в сосудах из полиэтилена или тефлона.
Кислородсодержащие соединения галогенов. Все галогены, кроме фтора, могут образовывать соединения, в которых они обладают положительной степенью окисления. Наиболее важными из таких соединений являются кислородсодержащие кислоты галогенов типа НСlOn (n = 1— 4) и соответствующие им соли и ангидриды.
Рассмотрим структурные формулы этих кислот:

Хлорноватистая

Хлористая

Хлорноватая

Хлорная
Для диссоциации по кислотному типу необходим разрыв связи О—Н. Как можно объяснить уменьшение прочности этой связи в ряду НСlO — HClO2 — НClO3 — НClO4? В этом ряду увеличивается число атомов кислорода, связанных с центральным атомом хлора. Каждый раз, когда образуется новая связь кислорода с хлором, от атома хлора, а следовательно, и от первичной связи О—С1 оттягивается некоторая доля электронной плотности. В результате этого часть электронной плотности оттягивается и от связи О—Н, которая за счет этого ослабляется.
Такая закономерность — усиление кислотных свойств с возрастанием степени окисления центрального атома — характерна не только для хлора, но и для других элементов. Например, азотная кислота HNO3, в которой степень окисления азота равна 5+, является более сильной кислотой, чем азотистая кислота HNO2 (степень окисления азота 3+); серная кислота H2SO4 (S6+) — более сильная, чем сернистая кислота Н2SО3 (S4+).
Из солей кислородсодержащих кислот хлора наибольшее значение имеют бертолетова соль (хлорат калия) КсlO3 и хлорная (“белильная”) известь. В лабораторной практике КClO3 широко используется для получения О2 (в присутствии MnO2 в качестве катализатора).
Хлорную известь получают действием хлора на гидроксид кальция (“гашеную известь”):

Получаемую смесь называют хлорной известью. Если формально просуммировать состав хлорной извести, то его можно выразить как CaOCl2. Таким образом, хлорная известь представляет собой смешанную соль — хлорид-гипохлорит кальция.
|
|
|


