 |
Основное уравнение кинетической теории газов.
|
|
|
|
Тема 2: ЗАКОНЫ И УРАВНЕНИЯ ИДЕАЛЬНЫХ ГАЗОВ
Лекция 2. Законы идеальных газов.
Основное уравнение кинетической теории газов.
Молекулярно-кинетическая теория газов, основываясь на законах движения и взаимодействия молекул, объясняет свойства газа и природу теплового движения. Основоположник этой теории Михаил Васильевич Ломоносов считал, что газ есть совокупность скопления громадного числа мельчайших частичек – молекул, которые при столкновении вступают во взаимодействие по законам упругого удара. Кинетическая теория газов была в дальнейшем развита Клазиусом, Менделеевым, Максвеллом, Больцманом, Пироговым и др. Теория устанавливает следующие положения:
1. строение всех газов дискретное, число молекул даже в малом объеме громадно;
2. молекулы идеальных газов представляют собой упругие шарообразные частицы ничтожно малого диаметра;
3. между молекулами не проявляются силы взаимодействия;
4. молекулы газа в любом объеме распределяются равномерно и находятся в хаотическом движении;
5. теплота есть беспорядочное движение частиц;
6. давление есть совокупность ударов молекул о стенки сосуда.
На основании этих положений и применения законов механики к движущимся молекулам выведено основное уравнение кинетической теории газов, которое имеет вид
 или
или  (1)
(1)
где р – абсолютное давление идеального газа на стенки сосуда;
п – число молекул в единице объема;
m – масса одной молекулы;
ω – средняя квадратичная скорость поступательного движения молекул;
выражение  определяет среднюю кинетическую энергию поступательного движения одной молекулы.
определяет среднюю кинетическую энергию поступательного движения одной молекулы.
Согласно основному положению кинетической теории газов, существует связь между средней кинетической энергией молекул газа и его абсолютной температурой:
|
|
|
 ,
,
где β – коэффициент пропорциональности, одинаковый для всех газов.
Подставляя значение  в основное уравнение, получим
в основное уравнение, получим
 , (2)
, (2)
т. е. давление прямо пропорционально числу молекул в единице объема и абсолютной температуре.
2. Законы Бойля – Мариотта, Гей-Люссака, Шарля.
Основные законы идеальных газов используются в технической термодинамике для решения целого ряда инженерно-технических задач в процессе разработки конструкторско-технологическойдокументации авиационной техники, авиадвигателей; их изготовления и эксплуатации.
Эти законы первоначально были получены экспериментальным путем. В последующем они были выведены из молекулярно-кинетической теории строения тел.
Закон Бойля – Мариотта устанавливает зависимость объема идеального газа от давления при постоянной температуре. Эту зависимость вывел английский химик и физик Р. Бойль в 1662 году задолго до появления кинетической теории газа. Независимо от Бойля в 1676 году этот же закон открыл Э. Мариотт. Закон Роберта Бойля (1627 – 1691), английского химика и физика, установившего этот закон в 1662 году, и Эдма Мариотта (1620 – 1684),французского физика, установившего этот закон в 1676 году: произведение объёма данной массы идеального газа на его давление постоянно при постоянной температуре или  .
.
Закон получил название Бойля – Мариотта и утверждает, что при постоянной температуре давление газа обратно пропорционально его объему.
Пусть при постоянной температуре некоторой массы газа имеем:
V 1– объем газа при давлении р 1;
V 2– объем газа при давлении р 2.
Тогда согласно закону можно записать
 (3)
(3)
Подставив в это уравнение значение удельного объема и принимая массу данного газа т = 1кг, получим
 (4)
(4)
откуда
p 1 v 1 = p 2 v 2 или p v = const. (5)
|
|
|
Плотность газа – величина, обратная его удельному объему:
 ;
; 
тогда уравнение (4) примет вид

т. е. плотности газов прямо пропорциональны их абсолютным давлениям. Уравнение (5) можно рассматривать как новое выражение закона Бойля – Мариотта которое можно сформулировать так: произведение давления на удельный объем определенной массы одного и того же идеального газа для различных его состояний, но при одинаковой температуре, есть величина постоянная.
Этот закон может быть легко получен из основного уравнения кинетической теории газов. Заменив в уравнении (2) число молекул в единице объема отношением N / V (V – объем данной массы газа, N – число молекул в объеме) получим
 или
или  (6)
(6)
Поскольку для данной массы газа величины N и β постоянны, то при постоянной температуре T = const для произвольного количества газа уравнение Бойля – Мариотта будет иметь вид
pV = const, (7)
а для 1 кг газа
p v = const.
Изобразим графически в системе координат р – v изменение состояния газа.
Например, давление данной массы газа объемом 1 м3 равно 98 кПа, тогда, используя уравнение (7), определим давление газа объемом 2 м3

 кПа.
кПа.
Продолжая расчеты, получим следующие данные: V (м3) равно 1; 2; 3; 4; 5; 6; соответственно р (кПа) равно 98; 49; 32,7; 24,5; 19,6; 16,3. По этим данным строим график (рис. 1).

Рис. 1. Зависимость давленияидеального газа от объема при
постоянной температуре
Полученная кривая – гипербола, полученная при постоянной температуре, называется изотермой, а процесс, протекающий при постоянной температуре, – изотермическим. Закон Бойля – Мариотта – приближенный и при очень больших давлениях и низких температурах для теплотехнических расчетов неприемлем.
Закон Г е й – Л ю с с а к а определяет зависимость объема идеального газа от температуры при постоянном давлении. (Закон Жозефа Луи Гей-Люссака (1778 – 1850), французского химика и физика, установившего впервые этот закон в 1802 году: объём данной массы идеального газа при постоянном давлении линейно возрастает с ростом температуры, то есть 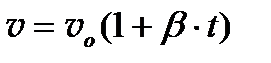 , где
, где  - удельный объём при
- удельный объём при  ; β – коэффициент объёмного расширения равный 1/273,16 на 1оС.) Закон установлен экспериментально в 1802 г. французским физиком и химиком Жозефом Луи Гей-Люссаком, именем которого назван. Исследуя на опыте тепловое расширение газов, Гей-Люссак открыл, что при неизменном давлении объемы всех газов увеличиваются при нагревании почти одинаково, т. е. при повышении температуры на 1°С объем некоторой массы газа увеличивается на 1/273 объема, который данная масса газа занимала при 0°С.
; β – коэффициент объёмного расширения равный 1/273,16 на 1оС.) Закон установлен экспериментально в 1802 г. французским физиком и химиком Жозефом Луи Гей-Люссаком, именем которого назван. Исследуя на опыте тепловое расширение газов, Гей-Люссак открыл, что при неизменном давлении объемы всех газов увеличиваются при нагревании почти одинаково, т. е. при повышении температуры на 1°С объем некоторой массы газа увеличивается на 1/273 объема, который данная масса газа занимала при 0°С.
|
|
|
Увеличение объема при нагревании на 1 °С на одну и ту же величину не случайно, а как бы является следствием закона Бойля – Мариотта. Вначале газ нагревается при постоянном объеме на 1 °С, давление его увеличивается на 1/273 начального. Затем газ расширяется при постоянной температуре, причем его давление уменьшается до начального, а объем во столько же раз увеличивается. Обозначив объем некоторой массы газа при 0°С через V 0, а при температуре t °C через Vt запишем закон следующим выражением:
 . (8)
. (8)
Закон Гей-Люссака также можно изобразить графически.

Рис. 2. Зависимость объема идеального газа от температуры при постоянном
давлении
Используя уравнение (8) и принимая температуру равной 0°С, 273 °С, 546 °С, вычислим объем газа, равный соответственно V 0, 2 V 0, 3 V 0. Отложим по оси абсцисс в некотором условном масштабе (рис. 2) температуры газа, а по оси ординат – соответствующие этим температурам объемы газа. Соединяя на графике полученные точки, получим прямую, представляющую собой график зависимости объема идеального газа от температуры при постоянном давлении. Такая прямая называется изобарой, а процесс, протекающий при постоянном давлении – изобарным.
Обратимся еще раз к графику изменения объема газа от температуры. Продолжим прямую до пересечения, с осью абсцисс. Точка пересечения будет соответствовать абсолютному нулю.
Предположим, что в уравнении (8) значение Vt = 0, тогда имеем:
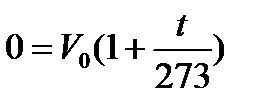
но так как V 0 ≠ 0, следовательно,  , откуда t = – 273°C. Но – 273°C=0К, что и требовалось доказать.
, откуда t = – 273°C. Но – 273°C=0К, что и требовалось доказать.
Представим уравнение Гей-Люссака в виде:

Помня, что 273+ t = Т, а 273 К=0°С, получим:
 или
или  . (9)
. (9)
Подставляя в уравнение (9) значение удельного объема и принимая т =1 кг, получим:
|
|
|
 или
или  (10)
(10)
Отношение (10) выражает закон Гей-Люссака, который можно сформулировать так: при постоянном давлении удельные объемы одинаковых масс одного и того же идельного газа прямо пропорциональны его абсолютным температурам. Как видно из уравнения (10), закон Гей-Люссака утверждает, что частное от деления удельногообъема данной массы газа на его абсолютную температуру есть величина постоянная при данном постоянном давлении.
Уравнение, выражающее закон Гей-Люссака, в общем виде имеет вид
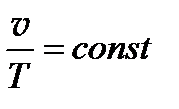 (11)
(11)
и может быть получено из основного уравнения кинетической теории газов. Уравнение (6) представим в виде

при p = const получаем уравнение (11). Закон Гей-Люссака широко применяется в технике. Так, на основе закона объемного расширения газов построен идеальный газовый термометр для измерения температур в пределах от 1 до 1400 К.
Закон Шарля устанавливает зависимость давления данной массы газа от температуры при постоянном объеме.ЗаконЖана Шарля (1746 – 1823),французского ученого, установившего этот закон впервые в 1787 году, и уточненный Ж.Гей-Люссакомв 1802 году: давление идеального газа неизменной массы и объёма возрастает при нагревании линейно, то есть  , где р о – давление при t = 0°C.
, где р о – давление при t = 0°C.
Шарль определил, что при нагревании в постоянном объеме давление всех газов увеличивается почти одинаково, т.е. при повышении температуры на 1 °С давление любого газа увеличивается точно на1/273 того давления, которая данная масса газа имела при 0°С. Обозначим давление некоторой массы газа в сосуде при 0°С через р 0, а при температуре t ° через p t. При повышении температуры на 1°С давление увеличивается на 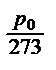 , а при увеличении на t °Cдавление увеличивается на
, а при увеличении на t °Cдавление увеличивается на  . Давление при температуре t °Cравно начальному плюс прирост давления
. Давление при температуре t °Cравно начальному плюс прирост давления  или
или
 ;
;
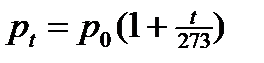 . (12)
. (12)
Формула (12) позволяет вычислить давление при любой температуре, если известно давление при 0°С. В инженерных расчетах очень часто используют уравнение (закон Шарля), которое легко получается из соотношения (12).
Поскольку  , а 273 + t = Т или 273 К = 0°С = Т 0
, а 273 + t = Т или 273 К = 0°С = Т 0
Имеем
 или
или  . (13)
. (13)
При постоянном удельном объеме абсолютные давления идеального газа прямо пропорциональны абсолютным температурам. Поменяв местами средние члены пропорции, получим
 или
или 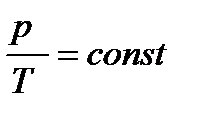 .(14)
.(14)
Уравнение (14) есть выражение закона Шарля в общем виде. Это уравнение легко вывести из формулы (6)
 .
.
При V = const получаем общее уравнение закона Шарля (14).
Для построения графика зависимости данной массы газа от температуры при постоянном объеме воспользуемся уравнением (13). Пусть, например, при температуре 273 К=0°С давление некоторой массы газа 98 кПа. По уравнению давление при температуре 373, 473, 573 °С соответственно будет 137 кПа (1,4 кгс/см2), 172 кПа (1,76 кгс/см2), 207 кПа (2,12 кгс/см2). По этим данным строим график (рис. 3). Полученная прямая называется изохорой, а процесс, протекающий при постоянном объеме, – изохорным.
|
|
|

Рис. 3. Зависимость давления газа от температуры при постоянном объеме
v 0
|
|
|


