 |
Коррозия и защита металлов
|
|
|
|
ХИМИЯ МЕТАЛЛОВ
Решение типовых задач
Пример 1. Для тантала (Та) выпишите валентные электроны в нормальном и возбужденном состояниях, перечислите все возможные степени окисления, приведите формулы оксидов и гидроксидов для наиболее устойчивых степеней окисления, указав их окислительно-восстановительный и кислотно-основной характер.
Р е ш е н и е
Тантал № 73 (Та).
Валентные электроны тантала:
нормальное состояние

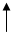
 6 s
6 s
 |
5 d;
степени окисления: 0, 1+, 2+, 3+;
возбужденное состояние




 6 р
6 р


6 s
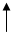







5 d;
степени окисления: 0, 1+, 2+, 3+, 4+, 5+.
Оксиды: ТаО; Та2О3; Та2О5
основной амфотерный кислотный.
Гидроксиды: Та(ОН)2; Та(ОН)3.
Окислительно-восстановительные свойства:
Та+ может отдать 4 электрона и присоединить 1 электрон;
Та2+ может отдать 3 электрона и присоединить 2 электрона;
Та3+ может отдать 2 электрона и присоединить 3 электрона;
Та4+ может отдать 1 электрон и присоединить 4 электрона;
следовательно, все они могут быть восстановителями и окислителями;
Та5+ - безусловный окислитель, так как может только принимать электроны.
Пример 2. Запишите предполагаемое уравнение химической реакции взаимодействия олова с азотной кислотой (концентрированной). Уравняйте стехиометрические коэффициенты ионно-электронным методом. Рассчитайте Δ G 0 химической реакции и сделайте вывод о ее термодинамической вероятности без учета перенапряжения.
Р е ш е н и е
n 
 |
Cu + HNO3 (конц) = Cu(NO3)2 + H2O + NO2
восст. окисл.
Cu - 2 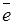 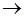 Cu2+
(NO3) – + 2H+ Cu2+
(NO3) – + 2H+  NO2 + H2O NO2 + H2O
| |
| Cu + 2(NO3) – + 4H+ = Cu2+ + 2NO2 + 2H2O |

2NO 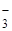 2NO
2NO 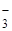
Cu + 4HNO3 = Cu(NO3)2 + 2NO2 + 2H2O.
φ  = + 0,34 В; φ
= + 0,34 В; φ 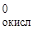 = +0,77 В; Е 0 = φ
= +0,77 В; Е 0 = φ 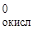 - φ
- φ  ;
;
|
|
|
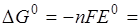 -2·96500(0,77 – 0,34) ·10-3 = -82,99 кДж/моль.
-2·96500(0,77 – 0,34) ·10-3 = -82,99 кДж/моль.
Реакция термодинамически вероятна.
Пример 3. По значениям электродных потенциалов окислителя и восстановителя выясните, может ли хром применяться для восстановления ионов олова и бария из отработанных электролитов?
Р е ш е н и е
n 



2Сr + 3SnCl2 = 2CrCl3 + 3Sn0
восст. окисл.
φ 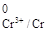 = - 0,744 В; φ
= - 0,744 В; φ  = -0,136 В.
= -0,136 В.
Так как φокисл > φвосст, реакция термодинамически вероятна.
2Cr + 3Ba(NO3)2 = 3Ba0 + 2Cr(NO3)3
восст. окисл.
φ 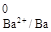 = -2,9 В.
= -2,9 В.
Так как φокисл < φвосст, реакция термодинамически невозможна.
Следовательно, хром может использоваться только для восстановления олова из раствора SnCl2.
Пример 4. Для подготовки поверхности перед нанесением защитного покрытия требуется удалить оксиды металлов, образовавшиеся самопроизвольно или в результате термообработки. Исходя из кислотно-основного характера оксидов и приведенных данных рассчитайте, в каком из двух электролитов (H2SO4, KOH) оксид FeO может быть удален полностью.
Р е ш е н и е
Оксид – FeO; масса оксида равна 100 г; электролиты - H2SO4, KOH с концентрацией 3 моль/л, объемом 1,5 л.
Оксид FeO обладает основными свойствами и поэтому взаимодействует с кислотами
FeO + H2SO4 = FeSO4 + H2O.
Число молей FeO (n) равно числу молей H2SO4:
 .
.
Масса FeO (m):  72·4,5 = 324 г.
72·4,5 = 324 г.
Таким образом, оксид FeO массой 100 г может быть полностью удален с поверхности, так как электролита хватает для стравливания гораздо большей массы FeO.
Пример 5. С целью удаления дефектного покрытия, основную часть которого составляет железо, образец подвергается травлению в азотной кислоте в течение 15 мин. Рассчитайте, какой объем азотной кислоты потребуется для полного удаления покрытия. Площадь поверхности образца 5 см2, концентрация азотной кислоты 2 моль/л, скорость травления V тр равна 0,112 г/см2.
Р е ш е н и е
2 Fe + 8HNO3 = 3Fe(NO3)2 + 2NO + 4H2O
Масса железа, вступающего в реакцию, по уравнению равна 2·55,6 г. На 2 моля железа приходится 8 молей азотной кислоты.
|
|
|
2·55,6 г Fe реагирует с 8 молями HNO3
х г Fe реагирует с 2 моль/л· V л HNO3
(масса Fe) х = 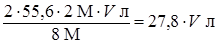 ;
;
масса Fe = V тр ·t·S = 0,112 г/см2·15 мин·5 см2 = 8,4 г,
(объем электролита HNO3) V = 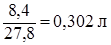 .
.
Задачи
7.1. Для указанных металлов выпишите валентные электроны в нормальном и возбужденном состояниях, перечислите все возможные степени окисления, приведите формулы оксидов и гидроксидов для наиболее устойчивых степеней окисления, указав их окислительно-восстановительный и кислотно-основной характер.
Таблица 7.1
| Вариант | Металл | Вариант | Металл |
| Ti | 1’ | Fe | |
| Pt | 2’ | Ru | |
| Zn | 3’ | Cr | |
| V | 4’ | Rb | |
| Ag | 5’ | In | |
| Ga | 6’ | Cd | |
| Cu | 7’ | Zr | |
| W | 8’ | Sn | |
| Al | 9’ | Hg | |
| Nb | 10’ | Mo | |
| Sr | 11’ | Re | |
| Ni | 12’ | Au | |
| Mn | 13’ | La | |
| Ba | 14’ | Pb | |
| Hf | 15’ | Cd |
7.2. Запишите предполагаемое уравнение химической реакции взаимодействия металла с указанным электролитом. Уравняйте стехиометрические коэффициенты ионно-электронным методом. Рассчитайте ΔG химической реакции и сделайте вывод о ее термодинамической вероятности без учета перенапряжения.
Таблица 7.2
| Вариант | Металл | Электролит | Вариант | Металл | Электролит |
| Cu | H2SO4, конц. | 1’ | Ti | HCl, pазб. | |
| Zn | H2SO4, pазб. | 2’ | V | H2SO4, конц. | |
| Al | NaOH | 3’ | Fe | NaOH | |
| Sn | H2SO4, конц. | 4’ | Ag | H2SO4, конц. | |
| Mg | H2O | 5’ | Sr | H2O | |
| Ni | HNO3, разб. | 6’ | Zn | H2SO4, конц. | |
| Ga | H2SO4, pазб. | 7’ | Fe | H2SO4, конц. | |
| Cr | HNO3, разб. | 8’ | Pb | H2SO4, конц. | |
| Ga | H2SO4, конц. | 9’ | Ag | HNO3, разб. | |
| Al | HNO3, конц. | 10’ | Sn | HCl, pазб. | |
| Pb | HNO3, разб. | 11’ | V | HNO3, разб. | |
| Ca | H2O | 12’ | Sr | H2SO4, pазб. | |
| Cr | H2SO4, pазб. | 13’ | Cu | HNO3, конц. | |
| Ga | NaOH | 14’ | Mg | HNO3, разб. | |
| Ni | H2SO4, конц. | 15’ | Ca | H2SO4, pазб. |
7.3. По значениям электродных потенциалов окислителя и восстановителя выясните, может ли данный металл применяться для восстановления ионов металлов из отработанных электролитов.
Таблица 7.3
| Вари-ант | Металл | Электролит | Вари-ант | Металл | Электролит |
| Fe | SnCl2, MnSO4 | 1’ | Ca | LiCl, Co(NO3)2 | |
| Zn | GaCl3,Ba(NO3)2 | 2’ | Cr | FeCl2, MgCl2 | |
| Mg | Ca(NO3)2, MnCl2 | 3’ | Sn | In(NO3)3, Cd(NO3)2 | |
| In | CuSO4, CrCl3 | 4’ | Ag | Sr(NO3)2, CdCl3 | |
| Co | FeSO4, PbCl2 | 5’ | Fe | VCl2, Mn(NO3)2 | |
| Ni | SnCl2, LiCl | 6’ | Sr | ZnSO4, NiSO4 | |
| Cd | Co(NO3)2, Pb(NO3)2 | 7’ | Al | MnCl2, LaCl3 | |
| Cu | Ga(NO3)3, AgNO3 | 8’ | Ti | Co(NO3)2, CrCl3 | |
| Ba | FeCl2, Mg(NO3)2 | 9’ | V | FeSO4, AlCl3 | |
| Hg | InCl3, CuSO4 | 10’ | Co | Ba(NO3)2, SnCl2 | |
| Pb | LaCl3, Cu(NO3)2 | 11’ | Mn | InCl3, MgCl2 | |
| Sn | Cr2(SO4)3, AgNO3 | 12’ | Pb | Sn(NO3)2, CuSO4 | |
| Mn | BaCl2, GaCl3 | 13’ | In | GaCl3, Pb(NO3)2 | |
| Ga | PbCl2, In(NO3)3 | 14’ | Al | SrCl2, V(NO3)2 | |
| La | SnSO4, SrCl2 | 15’ | Cr | Al(NO3)3, CdCl2 |
|
|
|
7.4. Для подготовки поверхности перед нанесением защитного покрытия требуется удалить оксиды металлов, образовавшиеся самопроизвольно или в результате термообработки. Исходя из кислотно-основного характера оксидов и приведенных данных, рассчитайте, в каком из двух предлагаемых электролитов оксид может быть удален полностью. Концентрация электролитов 3 моль/л, объем 1,5 л, масса оксида 100 г.
Таблица 7.4
| Вариант | Оксид | Электролиты | Вариант | Оксид | Электролиты |
| FeO | HNO3, NaOH | 1’ | TiO2 | H2SO4, NaOH | |
| Al2O3 | HCl, KOH | 2’ | SnO2 | HNO3, KOH | |
| MnO3 | H2SO4, NaOH | 3’ | CuO | H2SO4, KOH | |
| ZnO | H2SO4, NaOH | 4’ | PbO | HNO3, NaOH | |
| SnO | HNO3, KOH | 5’ | Nb2O5 | HCl, NaOH | |
| PbO2 | HCl, KOH | 6’ | CrO | H2SO4, KOH | |
| Cu2O | H2SO4, NaOH | 7’ | Mo2O3 | H2SO4, KOH | |
| Fe2O3 | HNO3, KOH | 8’ | ScO | HNO3, KOH | |
| MnO | HNO3, KOH | 9’ | Fe2O3 | HCl, NaOH | |
| NiO | H2SO4, NaOH | 10’ | Nb2O5 | H2SO4, NaOH | |
| V2O3 | H2SO4, KOH | 11’ | MgO | HNO3, KOH | |
| MoO | HNO3, KOH | 12’ | Ru2O3 | HNO3, NaOH | |
| Sc2O3 | H2SO4, NaOH | 13’ | BaO | H2SO4, KOH | |
| CaO | HCl, NaOH | 14’ | Cr2O3 | H2SO4, KOH | |
| CrO3 | H2SO4, KOH | 15’ | Mn2O3 | HNO3, NaOH |
7.5. С целью удаления дефектного покрытия, основную часть которого составляет указанный металл, образец подвергается травлению в электролите. Рассчитайте, какой объем электролита потребуется для полного удаления покрытия. Площадь поверхности образца 5 см2, концентрация электролита (с), время обработки (t) и скорость травления (V тр) приведены в таблице. При записи уравнения химической реакции учтите концентрацию кислоты (концентрированная или разбавленная).
Таблица 7.5
| Вариант | Металл | Электролит | с,моль/л | t, мин | V тр, г/см2·мин |
| Cu | HNO3 | 0,128 | |||
| Fe | HCl | 0,280 | |||
| Mg | H2SO4 | 3,5 | 0,458 | ||
| Zn | HCl | 2,5 | 0,109 | ||
| Ti | HNO3 | 4,5 | 0,130 | ||
| Ni | H2SO4 | 0,590 | |||
| Co | HNO3 | 5,5 | 0,074 | ||
| Cu | H2SO4 | 0,320 | |||
| Zn | H2SO4 | 0,392 | |||
| Продолжение табл. 7.5 | |||||
| Sn | HNO3 | 0,148 | |||
| Ni | HNO3 | 4,5 | 0,113 | ||
| Fe | H2SO4 | 0,112 | |||
| Al | HCl | 1,5 | 0,068 | ||
| Cd | HNO3 | 3,5 | 0,262 | ||
| Ti | HNO3 | 0,407 | |||
| 1’ | Pb | HNO3 | 3,5 | 0,310 | |
| 2’ | Co | H2SO4 | 3,5 | 0,304 | |
| 3’ | Mg | HCl | 0,432 | ||
| 4’ | Al | H2SO4 | 1,5 | 0,108 | |
| 5’ | Cr | HNO3 | 0,390 | ||
| 6’ | Mn | H2SO4 | 0,336 | ||
| 7’ | Co | HCl | 0,094 | ||
| 8’ | In | H2SO4 | 0,382 | ||
| 9’ | Sn | HNO3 | 0,298 | ||
| 10’ | Fe | HNO3 | 0,400 | ||
| 11’ | Al | HNO3 | 2,5 | 0,420 | |
| 12’ | Cd | H2SO4 | 0,300 | ||
| 13’ | Pb | HNO3 | 0,550 | ||
| 14’ | Mg | H2SO4 | 0,642 | ||
| 15’ | Zn | HNO3 | 3,5 | 0,228 |
|
|
|
7.6. Олово со свинцом образует легкоплавкую эвтектику «третник», являющуюся припоем при низкотемпературной пайке различных металлов. Рассчитайте, какой объем газа выделится при растворении 15 г припоя, содержащего 61 % Sn и 39 % Pb в концентрированной азотной кислоте при н.у., учитывая, что олово растворяется с образованием оловянной кислоты H2SnO3, а свинец образует нитратную соль.
7.7. Одним из методов очистки ртути от примесей является промывка в слабом растворе HNO3. Ртуть в нем не растворяется, а примеси металлов переходят в ионное состояние. Рассчитайте, какой объем 0,5 моль/л раствора HNO3 потребуется для очистки Hg(Zn) массой 10 г, если загрязненность цинком составляет 25 масс.%. Продуктом восстановления азотной кислоты считать N2.
7.8. Для металлургии хром получают в виде сплава с железом (феррохром) восстановлением хромистого железняка  углем в электрической печи. Рассчитайте, сколько Fe, Cr и CO получится при восстановлении 1 кг железняка.
углем в электрической печи. Рассчитайте, сколько Fe, Cr и CO получится при восстановлении 1 кг железняка.
7.9. Проанализируйте характер изменения кислотно-основных свойств в ряду оксидов металлов: Ga2O3 – In2O3 – Tl2O3 и оцените, какой из оксидов более энергично взаимодействует с простыми кислотами. Ответ обоснуйте расчетом Δ G химического взаимодействия оксидов с HCl.
7.10. При взаимодействии ниобия со фтором и последующим растворением полученного пентафторида во фториде калия получается комплексная соль гексафторониобата калия. Рассчитайте массу комплексной соли, которая может быть получена из 20 г Nb.
7.11. Карбид натрия получается при непосредственном взаимодействии металла с углеродом и далее разлагается водой с выделением гидроксида металла и углеводорода. Запишите уравнения химических реакций и рассчитайте массу натрия, если в результате взаимодействия получено 11,2 л метана - СН4.
7.12. Основным природным минералом марганца является пиролюзит MnO2. Рассчитайте, сколько марганца образуется при восстановлении его из 1 кг MnO2 методом кремнийтермии.
7.13. Ванадий взаимодействует при сплавлении со щелочами в присутствии окислителей (например, О2, Н2О2 и др.) с образованием анионного оксикомплекса [VO4]3-. Рассчитайте, сколько кислорода необходимо израсходовать для полного сплавления 5 г ванадия с КОН.
|
|
|
7.14. Рений, который входит в состав жаростойких покрытий и используется в электротехнической промышленности, обычно выделяют нагреванием NH4ReO4 в токе водорода. Рассчитайте, какое количество рения и азота можно получить из 1,5 кг рениевокислого аммония.
7.15. Гафний относительно легко растворяется в царской водке (смеси соляной и азотной кислот) с образованием комплексного соединения Н2[HfCl6]. Рассчитайте объем оксида азота (II), который выделится при полном растворении 15 г Hf.
7.16. В процессе отделения самородного золота от пустой породы одной из операций является его вытеснение из цианистых электролитов цинком по реакции
2Na[Au(CN)2] + Zn = Na2[Zn(CN)4] + 2Au.
Рассчитайте массу золота, которая может быть получена из 2 л 0,3 моль/л раствора дицианоаурата (I) натрия.
7.17. Рутений в виде компактного металла устойчив по отношению к кислотам и их смесям, но разрушается при сплавлении со щелочами в присутствии кислорода. Рассчитайте, какое количество Na2RuO4 образуется при полном сплавлении 20 г Ru с гидроксидом натрия и какой объем водяного пара при этом выделяется.
7.18. Платина (подобно золоту) растворяется лишь в царской водке (смеси азотной и соляной кислот). Рассчитайте, какой объем (н.у.) окиси азота (II) выделится при растворении 10 г Pt.
7.19. Объясните, как изменяются окислительные свойства гексафторидов металлов в ряду от WF6 до PtF6.
7.20. 12 %-ная хромистая нержавеющая сталь марки ЭИ-961 с малым содержанием никеля применяется для изготовления дисков, лопаток, пружин сжатия и других деталей, работающих в условиях нагрева до 600 оС и повышенной влажности. Рассчитайте массовое содержание элементов в 1 кг такой стали, если ее процентный состав: С – 0,15; Mn – 11; Ni – 12; W – 20; V – 0,20; Mo – 0,50; остальное Fe.
7.21. Пирометаллургический процесс извлечения меди из сернистых руд типа медного колчедана выражается следующей суммарной реакцией:
2CuFeS2 + 5O2 + 2SiO2 = 2Cu + 2FeSiO3 + 4SO2.
Сколько меди можно получить из 1 т колчедана, если пустая порода составляет 28 %?
7.22. Кадмий, используемый для получения легкоплавких сплавов, электродов для щелочных аккумуляторов и других целей, получается пирометаллургическим методом из сернистой руды типа CdS. При этом сначала руда подвергается отжигу в кислороде, затем полученный оксид восстанавливают углем. Рассчитайте, сколько Cd можно получить из 500 кг такой руды?
7.23. Диоксиды актиноидов америция и самария являются сильными окислителями. Они, например, окисляют концентрированную соляную кислоту с выделением газообразного хлора. Рассчитайте, какое количество AmCl3 получается в результате реакции полного восстановления 40 г диоксида америция.
7.24. Объясните, как изменяются окислительные свойства производных актиноидов Э (VI) в ряду от U (№ 92) до Am (№ 95).
7.25. Карбонат железа растворяется в воде, содержащей двуокись углерода, благодаря образованию растворимого бикарбоната железа, который на воздухе превращается в Fe(OH)3. Учитывая это свойство, бутылки с минеральной водой, содержащей карбонаты железа, заполняются до отказа, чтобы исключить образование Fe(OH)3. Запишите, какие реакции возможны в данном случае.
7.26. Сколько металлического иридия можно получить при нагревании в присутствии кислорода 40 г сульфида Ir2S3 с последующим термическим разложением полученного оксида иридия?
7.27. Лантаноиды активно взаимодействуют с водой и слабо пассивируются гидроксидными пленками. Рассчитайте, какой объем водорода выделится, если реакции подвергается 45 г гадолиния.
7.28. Оцените и объясните изменение прочности оксидов марганца по значениям теплот образования (-Δ Н 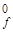 кДж/моль)
кДж/моль)
оксиды MnO Mn2O3 MnO2 Mn2O7
- Δ Н 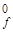 389,53 973,6 524,67 690,4.
389,53 973,6 524,67 690,4.
7.29. Для обезвоживания используется способность циркония разлагать воду при повышенных температурах с образованием оксида и гидроксида циркония (IV). Рассчитайте объем паров воды, который может быть уловлен при пропускании влажного газа через циркониевую сетку, если в реакцию вступает при этом 150 г поверхностного слоя Zr. Расчет ведите для н.у.
7.30. Какое количество металлического иридия, парообразного хлороводорода и хлорида аммония может быть получено при термическом разложении 200 г комплексной соли (NH4)2[IrCl6]?
7.31. При действии смеси СО2 и Н2 на порошкообразный металлический марганец образуется MnO и Mn3C. Рассчитайте, какое количество марганца вступает в реакцию, если в результате реакции выделяется 80 г MnO.
7.32. При нагревании без доступа воздуха 45 г металлического висмута с селеном получен селенид трехвалентного висмута Bi2Se3, который обладает фотоэлектрическими свойствами. При последующем окислении в кислороде образовалось 25 г SeO2. Рассчитайте, какая доля висмута подверглась окислению.
7.33. При температуре выше 700оС двуокись углерода окисляет молибден до трехокиси молибдена. Рассчитайте, какое количество МоО3 и СО образуется в результате окисления 120 г молибдена.
7.34. Одним из методов получения металлического хрома является кремнийтермическое восстановление оксида хрома (III) в присутствии СаО. Рассчитайте, какое количество кремния понадобится для восстановления 20 г хрома и сколько совместно с ним образуется СаSiО3.
7.35. Серебристо-белый порошок технеция, который является парамагнитным и тугоплавким металлом, получается искусственным путем: восстановлением при нагревании до 600 оС оксидов и сульфидов водородом в платиновой (или серебряной) лодочке, помещенной в трубку из тугоплавкого стекла. Рассчитайте, какое количество водорода потребуется для полного восстановления технеция из 120 г смеси порошков Тс2О7, ТсО2 и Тс2S7, в которой массовое соотношение компонентов составляет 1:2:3.
КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ
Решение типовых задач
Пример 1. Составьте уравнение реакции, протекающей при химической коррозии данного металла, рассчитайте 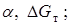 по таблицам
по таблицам  выберите металл, которым можно легировать данный металл.
выберите металл, которым можно легировать данный металл.
Дано: Fe, Fe2O3; T = 500 K. Начальное давление кислорода 
Р е ш е н и е
Для расчета используем табличные данные о зависимости упругости паров различных оксидов от температуры (табл.П 5). Вначале дадим характеристику процесса.
При химической коррозии данного металла протекает следующая реакция
2Fe (т) + 3/2О2 (г) = Fe2O3 (т).
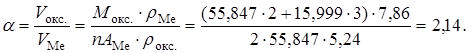
Отсюда следует, что металл стоек, так как значение 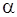 находится в пределах, обеспечивающих антикоррозионную защиту (
находится в пределах, обеспечивающих антикоррозионную защиту ( Вместе с тем, поскольку эта величина ближе к границам защитных значений, чем к их середине (
Вместе с тем, поскольку эта величина ближе к границам защитных значений, чем к их середине ( защиту следует считать относительной.
защиту следует считать относительной.
Величину 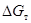 рассчитаем по формуле изотермы Вант-Гоффа, которая применительно к рассматриваемой реакции примет вид
рассчитаем по формуле изотермы Вант-Гоффа, которая применительно к рассматриваемой реакции примет вид

где  константа равновесия при температуре Т.
константа равновесия при температуре Т.
 .
.
По табл. П 5 находим упругость диссоциации Fe2O3 при 500 К
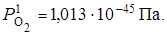
Затем рассчитываем 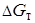 :
:
 2,303·8,3144·500·
2,303·8,3144·500·
·lg [(101325)-3/2 · (1,013·10-45)3/2] = - 646238,91 Дж/моль 
 - 646,3 кДж/моль < 0.
- 646,3 кДж/моль < 0.
Так как 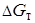 < 0, реакция может протекать слева направо самопроизвольно при Т = 500 К.
< 0, реакция может протекать слева направо самопроизвольно при Т = 500 К.
При выборе металла для легирования железа исходим из условия защиты
 оксида легирующего металла <
оксида легирующего металла <  оксида основы.
оксида основы.
Для железа при 298 К это алюминий

Пример 2. Напишите уравнения электрохимических реакций и уравнения реакций побочных процессов при коррозии данного металла с водородной деполяризацией. Укажите термодинамическую возможность коррозионного процесса. Рассчитайте разность потенциалов под током при коррозии с учетом перенапряжений.
Дано: Fe; pH < 7; pH 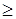 7.
7.
Р е ш е н и е
Анодная реакция Fe0 = Fe2+ + 2 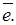
Полярность анода со стороны внешней цепи ( , со стороны электролита (+), процесс – окисление металла.
, со стороны электролита (+), процесс – окисление металла.
Катодные реакции
при рН < 7 2Н+ + 2 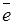 = Н2; при рН
= Н2; при рН 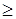 7 2Н2О + 2
7 2Н2О + 2 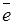 = 2ОН
= 2ОН  + Н2.
+ Н2.
Полярность катода со стороны внешней цепи (+), со стороны электролита  , процесс – восстановление окислителя.
, процесс – восстановление окислителя.
Побочные реакции
Fe2+ + 2OH  = Fe(OH)2
= Fe(OH)2 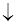 ;
;
2Fe(OH)2 + ½ O2 + H2O = 2Fe(OH)3 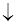 .
.
При дальнейших превращениях образуются сложные гидратированные оксиды – ржавчина FeO·Fe2O3·nH2O.
Термодинамическая возможность коррозии рассчитывается, исходя из стандартных электродных потенциалов
 (при рН = 7);
(при рН = 7); 
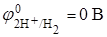 (при рН < 7);
(при рН < 7);  (при рН > 7, точнее рН = 14).
(при рН > 7, точнее рН = 14).
При рН < 7


Так как 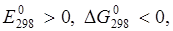 реакция коррозии в кислой среде термодинамически возможна.
реакция коррозии в кислой среде термодинамически возможна.
Термодинамическая возможность коррозии рассчитывается, исходя из стандартных электродных потенциалов
 (при рН=7);
(при рН=7); 
 (при рН< 7);
(при рН< 7);
 (при рН > 7, точнее рН = 14).
(при рН > 7, точнее рН = 14).
При рН < 7 

Так как 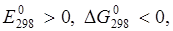 реакция коррозии в кислой среде термодинамически возможна.
реакция коррозии в кислой среде термодинамически возможна.
При рН = 7 

Так как 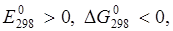 то процесс возможен и в нейтральной среде.
то процесс возможен и в нейтральной среде.
При рН > 7 (точнее при рН=14)
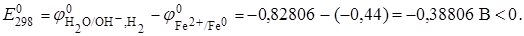

Так как  то при рН > 7 процесс термодинамически невозможен. Однако о его реальной возможности можно судить только с учетом кинетических данных.
то при рН > 7 процесс термодинамически невозможен. Однако о его реальной возможности можно судить только с учетом кинетических данных.
Расчет разности потенциалов под током при коррозии проводится с учетом кинетики процессов.
При рН < 7 

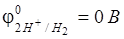 ;
;  (на Fe) = 0,2 B.
(на Fe) = 0,2 B.
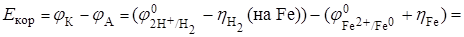
= (0 – 0,2) – (- 0,44 + 0,01) = 0,23 B > 0.
Так как Е > 0, то процесс при рН < 7 кинетически возможен.
При рН = 7 
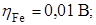

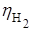 (на Fe) = 0,1 B.
(на Fe) = 0,1 B.
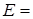 (- 0,414 – 0,01) – (- 0,440 + 0,010) = 0,006 В > 0.
(- 0,414 – 0,01) – (- 0,440 + 0,010) = 0,006 В > 0.
Так как Е > 0, то в нейтральной среде возможно незначительное (из-за малой величины Е) окисление железа.
Пример 3. Напишите уравнения электрохимических реакций и реакций побочных процессов при коррозии данного металла с кислородной деполяризацией. Укажите термодинамическую возможность коррозионного процесса. Рассчитайте разность потенциалов под током при рН < 7; рН 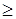 7.
7.
Дано: железо (Fe).
Р е ш е н и е
Анодная реакция Fe0 = Fe2+ + 2 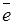 ;
;
Катодные реакции при рН < 7 О2 + 4Н+ + 4 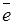 = 2Н2О;
= 2Н2О;
при рН 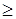 О2 + 2Н2О + 4
О2 + 2Н2О + 4 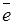 = 4ОН¯.
= 4ОН¯.
Побочные реакции описаны в предыдущем примере. Находим табличные данные 
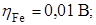
рН < 7 (pH = 0); 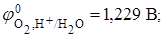
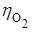 (на Fe) = 0,3 B;
(на Fe) = 0,3 B;
pH = 7 
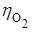 (на Fe) = 0,6 B;
(на Fe) = 0,6 B;
pH > 7 (pH=14) 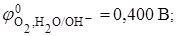
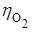 (на Fe) = 0,6 B.
(на Fe) = 0,6 B.
Термодинамическая возможность
pН < 7  1,229 – (- 0,440) = 1,669 В > 0;
1,229 – (- 0,440) = 1,669 В > 0;
4 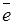
 |
реакция 2Fe0 + O2 + 4H+ = 2Fe2+ + 2H2O;
 = -644,234
= -644,234 
При рН < 7 процесс возможен.
рН = 7  0,815 – (- 0,440) = 1,255 В > 0;
0,815 – (- 0,440) = 1,255 В > 0;
4 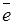
 |
реакция 2Fe0 + O2 + 2Н2О = 2Fe2+ + 4ОН¯;
 = - 484,43
= - 484,43 
При рН = 7 процесс возможен.
рН > 7  0,400 – (- 0,440) = 0,84 В > 0;
0,400 – (- 0,440) = 0,84 В > 0;
 = - 324,24
= - 324,24 
При рН > 7 процесс возможен.
Расчет разности потенциалов под током проводим с учетом перенапряжений
рН < 7 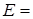 (1,229 – 0,300) – (- 0,44 + 0,01) = 1,359 В > 0;
(1,229 – 0,300) – (- 0,44 + 0,01) = 1,359 В > 0;
рН = 7 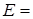 (0,815 – 0,6) – (-0,44 + 0,01) = 0,645 В > 0;
(0,815 – 0,6) – (-0,44 + 0,01) = 0,645 В > 0;
рН > 7 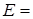 (0,400 – 0,6) – (-0,44 + 0,01) = 0,230 В > 0.
(0,400 – 0,6) – (-0,44 + 0,01) = 0,230 В > 0.
Таким образом коррозия железа кинетически возможна во всех рассматриваемых средах.
Пример 4. Выберите условия для защиты данного металла следующими способами: 1) катодной протекторной защитой; 2) катодной защитой внешним током; 3) анодной защитой внешним током. Для каждого случая составьте уравнения реакций на электродах с указанием вторичных процессов.
Дано: железо (Fe); рН < 7.
Р е ш е н и е
Исходя из стандартных электродных потенциалов 
 выбираем в качестве протектора более отрицательный металл – магний.
выбираем в качестве протектора более отрицательный металл – магний.
1) Для катодной протекторной защиты (или сокращенно «протекторной защиты») составляем схему
 |











