 |
Методика и порядок выполнения работы
|
|
|
|
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К практическим занятиям по дисциплине
«Физика аэрозолей»
(часть 2)
для студентов, обучающихся по направлению 08.03.01 «Строительство»
Ставрополь, 2017
 В методических указаниях сформулированы цели и задачи исследований, даны краткие основы по теоретическому обоснованию работ, приведены описания лабораторных стендов, изложена методика проведения экспериментальных исследований и обработки полученных данных.
В методических указаниях сформулированы цели и задачи исследований, даны краткие основы по теоретическому обоснованию работ, приведены описания лабораторных стендов, изложена методика проведения экспериментальных исследований и обработки полученных данных.
Методические указания выполнены согласно программе дисциплины «Физика аэрозолей» для студентов по направлению 08.03.01
«Строительство»
Методические указания позволяют:
• углубить знания студентов по теории процессов водоподготовки;
• уяснить физическую сущность процессов обработки воды;
• изучить методики экспериментального определения технологических показателей процессов обработки воды;
• получить необходимые навыки в проведении экспериментального исследования и обработки опытных данных.
Составитель: Беляев Е. И., Хащенко А.А.
Рецензент: Воронин А. И.
Практическое занятие № 4
ИССЛЕДОВАНИЕ ПРОЦЕССА ОСВЕТЛЕНИЯ ВОДЫ
4.1 Цель и содержание
Опытным путем определить технологические показатели процессов осветления воды естественным отстаиванием и с помощью коагуляции.
Теоретическое обоснование
Осветление воды - это процесс удаления из нее грубо- и мелкодисперсных частиц, обуславливающих степень ее мутности и имеющих большую плотность, чем плотность воды.
При осаждении тонущих в воде загрязняющих частиц под действием силы тяжести они оседают на дно резервуара (отстойника), в котором осветляемая вода находится в состоянии покоя или медленного движения.
|
|
|
Скорость их осаждения зависит от их размеров, плотности и коэффициента сопротивления воды движению частицы.
Для средне- и мелкодисперсных частиц эта скорость с некоторым приближением может определиться формулой Стокса:
 , мм/с,
, мм/с,
где  и
и  – плотность соответственно взвешенных частиц и воды,
– плотность соответственно взвешенных частиц и воды,
кг/м3;
g = 9.81 м/с2 – ускорение силы тяжести;
dэкв – эквивалентный диаметр частицы, м;
 – коэффициент динамической вязкости воды, н с/м2.
– коэффициент динамической вязкости воды, н с/м2.
В действительности взвешенные примеси в сточных и природных водах находятся в полудисперсном состоянии и обладают разной плотностью. Поэтому скорость их осаждения для конкретных существующих условий определяется опытным путем в лабораторных условиях с использованием мерных тарированных цилиндрических сосудов.
Имеются данные по скоростям осаждения частиц разных веществ и разного их размера в спокойной воде:
песчинки размером 7 ммоседают со скоростью 100 мм/с;
то же, соответственно 0,01 мм – 0,15 мм/с;
частицы глины размером 0,001 мм оседают со скоростью 0,0015 мм/с;
то же, соответственно 0,0001 мм – 0,000015 мм/с.
Естественное отстаивание взвешенных примесей при таких малых скоростях потребует громоздких и дорогостоящих сооружений.
Однако благодаря физико-химическим свойствам мелкодисперсные и коллоидные частицы в воде приобретают отрицательный электрический заряд за счет избирательного адсорбирования на своей поверхности ионов химических соединений, присутствующих в воде. Одноименно заряженные коллоидные частицы взаимно не слипаются. Но если в воду добавить частицы с противоположным зарядом, то будет наблюдаться взаимное слипание коллоидных и введенных в воду частиц, что приведет к укрупнению и утяжелению каждой частицы, а, следовательно, к значительному увеличению скорости их осаждения. Такое явление достигается при одновременном осуществлении процессов осветления и коагуляции. Коагуляция – это физико-химический процесс слипания отрицательно заряженных коллоидных частиц с положительно заряженными частицами – хлопьями, образующихся в результате дозирования в воду реагента – коагулянта. В качестве него используют сульфат или хлорид железа, или сернокислый алюминий. Эти химические соединения в воде гидролизуются с образованием нерастворимых мелкодисперсных хлопьев гидрооксида металла (АL(ОН)з; Fe(OH)2) с положительным электрическим зарядом:
|
|
|
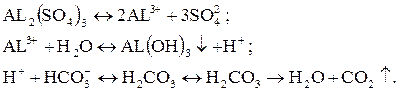
При этом образующийся кислотный показатель (Н +) нейтрализуется собственной щелочностью воды. Образовавшиеся дисперсные агрегаты из коллоидных частиц и хлопьев коагулянта уже способны к взаимному слипанию, образовывая крупные и тяжелые частицы, хорошо осаждаемые в отстойнике.
Для большинства сточных и природных вод доза сернокислого алюминия колеблется в пределах 0,5-1,2мг экв/л,а сернокислого железа 0,1-0,5 мг экв/л, при температуре подогрева обрабатываемой воды 25-40 оС и ее щелочности 1,5-2,0 мг экв/л.
Аппаратура и материалы
Экспериментальный стенд, схема приведена на рисунке 4.1.
Секундомер.
Весы аналитические с разновесами.
Фотоколориметр.
Мутномер.
Коагулянт – сульфат или хлорид железа или сернокислый алюминий.
Загрязнитель – глина или песок.
Стенд состоит из двух идентичных установок:
I – установка для осветления воды без коагуляции;
II – то же с коагуляцией.
Каждая установка состоит из колонки 1 отстаивания, представляющей цилиндрический тарированный сосуд; расходный сосуд 2 с приготовленным исходным раствором. Сосуды закрываются резиновыми пробками 4 со штуцерами 5, на конце которых установлены запорные краны 6. Расходные сосуды 2 с колонками 1 соединяются резиновым шлангом 7 с регулирующим краном 8.

А – осветление воды без коагуляции
Б – осветление воды с коагуляцией
Рисунок 4.1 -Схема экспериментального стенда
Режим отстаивания воды в колонке фиксируется высотой осветления воды тарированными рисками на цилиндре и временем отстоя с помощью секундомера.
Показатели качества осветленной воды (прозрачность) определяются при помощи мутномера (по кресту) или при помощи фотоколориметра, предварительно оттарированного по мутномеру.
|
|
|
Методика и порядок выполнения работы
Проводятся одновременно два опыта:
– отстаивание загрязненной воды без коагуляции;
– то же с коагуляцией.
Для приготовления загрязненной воды можно попеременно использовать два вещества: мелкий песок и глину.
В обоих расходных сосудах приготовить исследуемую загрязненную воду с концентрацией загрязнений С3= 300 г/м3 (мг/л).Для этого оба расходных сосуда залить чистой водой объемом Ve, равным объему колонки 1. Взвесить две навески выбранного загрязнителя (песка или глины) на аналитических весах массой:
 , г,
, г,
где Vв - объем воды, заливаемый в расходный сосуд, м3.


dK – диаметр колонки, м;
Нк – высота колонки, м.
Затем взвесить одну навеску коагулянта – сернокислого железа массой:
 , г,
, г,
где Ск = 0,5 г экв/м3 = 40 г/м3 (мг/л)– доза коагулянта.
Растворить дозу коагулянта в отдельной посуде. Высыпать навески загрязнителя в оба сосуда, тщательно перемешать до полного и равномерного распределения загрязнителя во всем объеме воды. Затем во второй сосуд плавно вылить полученный раствор коагулянта, не прекращая перемешивание воды в течение 5 минут в обоих сосудах. После этого вылить полученные растворы в соответствующие колонки. Зафиксировать уровень воды в колонках и начать отсчет времени. Через каждые 5 минутфиксировать по рискам тарированной шкалы колонки положение уровня просветления воды. Замеры вести в течение 50–60 минут. Результаты фиксируемых замеров в нарастающем порядке записывать в протокол-формуляр, таблица 4.1.
Для обоих режимов рассчитать скорость естественного осаждения загрязнений для 5–6замеров по формуле:

 , м/с,
, м/с,
где  – суммарный объем осветленной воды в колонке при i– мзамере, мл;
– суммарный объем осветленной воды в колонке при i– мзамере, мл;
 – суммарное время осветления воды в колонке, мин;
– суммарное время осветления воды в колонке, мин;
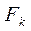 = 0,785*
= 0,785*  – сечение колонки, м.
– сечение колонки, м.
Затем рассчитать эту же среднюю скорость по ранее приведенной
формуле Стокса.
По результатам замера построить зависимость относительного объема в процентах осветленной воды от времени осветления для обоих режимов.
|
|
|
Так же для обоих режимов построить кривые зависимости скорости осаждения взвеси от нарастающего относительного объема в процентах осветления воды.
Определить прозрачность осветленной воды для обоих случаев обработки при помощи мутномера и при помощи фотоколориметра.
Таблица 4.1 – Протокол опытов
| № замеров | Время замера  , мин , мин
| Нарастающий объем осветленной воды | Скорость осветления | Прозрач-ность воды | ||||
| 1–й опыт | 2–й опыт | 1–й опыт | 2–й опыт | |||||
| vi, мл | vi, % | vi, мл | vi, % | wi, м/с | wi, м/с | |||
Содержание отчета и его форма
Отчет по выполненной работе должен содержать следующее:
– краткое описание основных положений теории осветления воды с коагуляцией;
– описание экспериментального стенда;
– порядок проведения экспериментальных опытов и результаты обработки опытных данных.
Вопросы для защиты работы
1. Физическая сущность процессов осветления и коагуляции.
2.Сущность технологии осветления.
3.Основные технологические параметры процессов коагуляции и
осветления.
4.Устройство опытного стенда.
5. Обработка опытных данных.
6. Методика измерения прозрачности воды.
Практическое занятие № 5
|
|
|


