 |
Реакции с участием комплексных соединений, не сопровождающиеся разрушением комплексного иона.
|
|
|
|
Неорганическая химия
ЛАБОРАТОРНАЯ РАБОТА № 7
Исследование комплексных соединений
Выполнил: студент НГ-07-2
Асамоах-Куампах Эдем
Проверил:Берлинский И.В.
САНКТ-ПЕТЕРБУРГ,
2007г.
Цель работы: познакомиться с методами получения комплексных соединений и их свойствами.
Общие сведения.
Комплексными называют соединения, в структуре которых можно выделить центральный атом – акцептор электронов, находящийся в донорно-акцепторной связи с определенным числом доноров-лигандов. Лигандами могут быть как ионы, так и нейтральные молекулы. Центральный атом и лиганды образуют внутреннюю сферу комплексного соединения, которую при записи формулы выделяют квадратными скобками. Внутренняя сфера часто имеет заряд, который компенсируют противоположно заряженные ионы, располагающиеся во внешней сфере. Внешнесферные ионы не имеют связей с центральными атомами, а образуют ионные связи с комплексными ионами. Поэтому в полярных растворителях комплексные соединения диссоциируют на комплексный и внешнесферный ионы, например:
K3[Fe(CN)6]ó3K++[Fe(CN)6]3-
[Co(NH3)4(SO4)]Cló [Co(NH3)4(SO4)]++Cl
В первом случае в растворе практически отсутствуют цианид-ионы, поэтому соединение не относится к сильнодействующим ядам. Второе соединение будет давать в растворе качественную реакцию на хлорид-ион (образование осадка AgCl) и не будет давать осадок BaSO4 с растворами солей бария.
Первое соединение является анионным комплексом, поскольку содержит в своей структуре и образует при диссоциации в растворе комплексные анионы. Второе соединение является катионным комплексом. Существуют и нейтральные комплексы, у которых внутренняя сфера не имеет заряда, соответственно, внешняя сфера отсутствует, например, [Pt(NH3)2Cl2].
|
|
|
При записи формулы комплексного соединения его составные части располагают в порядке возрастания электроотрицательности. На первом месте помещают внешнесферные катионы, затем центральный атом, далее нейтральные лиганды, лиганды-анионы и в конце формулы записывают внешнесферные анионы. Читают формулу в английском языке слева направо, но в русском – справа налево. При этом название внутренней сферы произносят в одно слово, используя соединительную гласную -о-, название комплексного аниона заканчивают суффиксом -ат. Молекулы воды в качестве лигандов обозначают термином «акво-», а молекулы аммиака – термином «аммино». Степень окисления центрального атома при записи названия комплекса указывают римской цифрой в круглых скобках, заряды ионов – арабскими цифрами. Например, первое из приведенных выше комплексных соединений мы назовем гексаноциферат (III) калия, второе – хлорид сульфатотетраамминокобальта (III), третье – дихлородиамминоплатина (II).
Число связей, образуемых лигандом с центральным атомом, называют дентатностью лиганда. Например, CN-, NH3 – монодентатные лиганды, а сульфат-ион – бидентатный лиганд. Число связей, образуемых центральным атомом с лигандами, называют координационным числом. Если лиганды монодентатные, координационное число равно числу лигандов: в первом примере – 6, в третьем примере –4. Однако во втором примере число лигандов равно 5, а координационное число кобальта – 6, поскольку сульфат-ион бидентатен.
K3[Fe(CN)6]ó3K++[Fe(CN)6]3-
[Co(NH3)4(SO4)]Cló [Co(NH3)4(SO4)]++Cl
[Pt(NH3)2Cl2].
Ход работы:
Образование комплексных соединений.
Опыт №1.
«Образование аминокомплекса серебра».
Налил в пробирку 3-4 капли раствора нитрата серебра, добавил столько же раствора хлорида натрия. Отметил выпадение осадка хлорида серебра. Затем в вытяжном шкафу добавил в пробирку 3-5 капель концентрированного раствора аммиака и несколько раз встряхнул.
|
|
|
 - образовался белый осадок.
- образовался белый осадок.
 - осадок растворился вследствие образования аминокомплекса серебра.
- осадок растворился вследствие образования аминокомплекса серебра.
Опыт №2.
«Получение аминокомплекса никеля».
Налил в пробирку 3-4 капли раствора сульфата никеля. Добавил каплю разбавленного раствора аммиака. В пробирке образовался студенистый осадок. Добавил в вытяжном шкафу 4-10 капель концентрированного раствора аммиака до полного растворения осадка. К полученному раствору добавил 1 мл насыщенного раствора бромида калия.
 - образовался студенистый осадок.
- образовался студенистый осадок.
 - раствор стал голубым вследствие образования в растворе катиона гексааминоникеля.
- раствор стал голубым вследствие образования в растворе катиона гексааминоникеля.
 - выпал осадок комплексной соли – бромида гексааминоникеля.
- выпал осадок комплексной соли – бромида гексааминоникеля.
Опыт №3.
«Образование аминокомплекса меди».
Налил в пробирку 3-5 капель раствора сульфата меди (II) и добавил по каплям концентрированный раствор аммиака. В первый момент выделился осадок сульфата гидроксомеди (II), который затем растворяется вследствие образования аминокомплекса меди.
 - раствор стал синим, так как в нем присутствуют катионы тетрааминомеди (2+).
- раствор стал синим, так как в нем присутствуют катионы тетрааминомеди (2+).
Опыт 4.
«Получение комплексного йодида ртути».
Налил в пробирку 3-4 капли раствора нитрата ртути (II) и добавил 1-2 капли раствора йодида калия. Затем в пробирку по каплям добавляем избыток раствора йодида калия до полного растворения полученного осадка, которое обусловлено образованием в растворе комплексных анионов тетрайодомеркурата (2-).
 - образовался оранжевый осадок.
- образовался оранжевый осадок.
 - осадок растворился.
- осадок растворился.
Этот анион можно выделить в осадок ионами серебра или кобальта (2+). Разделяю раствор тетрайодомеркурата на две части. В первую пробирку добавляю 1-2 капли раствора нитрата серебра, во вторую –1-2 капли раствора сульфата кобальта (II).
 - образовался осадок желтого цвета.
- образовался осадок желтого цвета.
 - образовался осадок розового цвета.
- образовался осадок розового цвета.
Опыт №5.
«Образование гидроксомплекса цинка».
Налил в пробирку 3-4 капли раствора сульфата цинка и добавляю по каплям 0,2 н. раствор гидроксида натрия, находящийся в штативе с реактивами, до выпадения осадка гидроксида цинка. Затем в вытяжном шкафу добавляю по каплям 6 н. раствор едкого натра до полного растворения осадка.
|
|
|
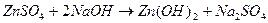 - выпал студенистый осадок.
- выпал студенистый осадок.
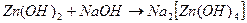 - осадок полностью растворился вследствие образования комплексного аниона тетрагидроксоцинка (2-).
- осадок полностью растворился вследствие образования комплексного аниона тетрагидроксоцинка (2-).
Реакции с участием комплексных соединений, не сопровождающиеся разрушением комплексного иона.
Опыт №6.
«Образование труднорастворимого гексаноциферрата (III»).
А. Налил в пробирку 3-4 капли раствора гексаноциферрата (II) калия  . Добавил 2-3 капли раствора трихлорида железа.
. Добавил 2-3 капли раствора трихлорида железа.
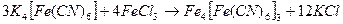 - образуется осадок цвета берлинской лазури, используемой для производства художественных красок. Реакция служит для обнаружения катионов
- образуется осадок цвета берлинской лазури, используемой для производства художественных красок. Реакция служит для обнаружения катионов  .
.
Б. Налил в пробирку 3-4 капли раствора гексацианоферрата (III) калия  . Добавляю 2-3 капли раствора сульфата железа (II).
. Добавляю 2-3 капли раствора сульфата железа (II).
 - образуется осадок, который в прошлом веке называли турнбулевой синью. В настоящее время установлено, что берлинская лазурь и турнбулева синь – одно и то же вещество, а именно: гексаноциферрат (III) железа (II)
- образуется осадок, который в прошлом веке называли турнбулевой синью. В настоящее время установлено, что берлинская лазурь и турнбулева синь – одно и то же вещество, а именно: гексаноциферрат (III) железа (II)  . Данная реакция служит для обнаружения катионов
. Данная реакция служит для обнаружения катионов 
Опыт №7.
«Образование труднорастворимых гексаноциферратов (II»).
Налил в две пробирки по 3-4 капли раствора гексаноциферрата (II) калия. В первую пробирку добавил 2-3 капли раствора сульфата цинка, во вторую – столько же раствора сульфата меди (II).
 - образовался желтый осадок.
- образовался желтый осадок.
 - образовался коричнево-зеленый осадок.
- образовался коричнево-зеленый осадок.
Опыт №8.
«Образование труднорастворимого гексанитрокобальта (III) натрия-калия».
Реакция служит для обнаружения в растворах катионов калия. Налил в пробирку 3-4 капли раствора  и добавил 2-3 капли раствора хлорида калия.
и добавил 2-3 капли раствора хлорида калия.
 - образуется осадок желтого цвета комплексной соли
- образуется осадок желтого цвета комплексной соли  .
.
|
|
|


