 |
Фторхинолоны в АТХ-классификации
|
|
|
|
Согласно АТХ-классификации хинолоны относятся к фармакологической подгруппе J01M (антибактериальные хинолоны). Среди них выделяют химические подгруппы J01MA (фторхинолоны) и J01MB (прочие хинолоны). В первую подгруппу входят офлоксацин (J01MA01), ципрофлоксацин (J01MA02), пефлоксацин (J01MA03), норфлоксацин (J01MA06), ломефлоксацин (J01MA07), левофлоксацин (J01MA12), моксифлоксацин (J01MA14); во вторую – налидиксовая кислота (J01MB02) и другие нефторированные хинолоны.
Хинолоны нарушают процесс синтеза ДНК в микробной клетке, что приводит к гибели последней. Основной первичной мишенью действия данной группы лекарственных веществ являются ферменты, ответственные за процесс нормального синтеза ДНК: топоизомераза II (ДНК-гираза) у грамотрицательных микроорганизмов и топоизомераза IV у грамположительных. У человека аналогичные ферменты имеют другое строение и не катализируют процесс суперспирализации ДНК.
Топоизомеразы II и IV выполняют важные функции в процессе формирования пространственной структуры молекулы ДНК при ее репликации. Бактериальные хромосомы в отличие от эукариотических имеют только одну точку начала репликации. Репликация ДНК происходит сразу в двух направлениях кольца хромосомы, при этом образуются две репликационные вилки. Раскручивание спирали ДНК в обоих направлениях должно вызвать скручивание хромосомы в направлении спирали (положительное суперскручивание) и сделать хромосому такой плотной, что репликация должна бы закончиться. ДНК-гираза предотвращает положительное суперскручивание, скручивая ДНК в противоположном направлении (катализирует отрицательное суперскручивание молекулы ДНК). Данный фермент разрезает ДНК и, держась у разрезанных концов молекулы, не позволяет молекуле раскручиваться, затем пропускает нетронутую нить через отверстие и запечатывает разрыв. Топоизомераза IV катализирует разъединение (декатенацию) ковалентно-замкнутых кольцевых молекул ДНК.
|
|
|
Бактериальные топоизомеразы, являющиеся мишенью действия хинолонов, состоят из четырёх субъединиц: по две субъединицы А и B у ДНК-гиразы и по две субъединицы ParC и ParE у топоизомеразы IV. Фторхинолоны первого поколения, как и нефторированные хинолоны, взаимодействуют в основном с ДНК-гиразой. Фторхинолоны второго и, особенно, третьего поколения имеют более высокое сродство с топои-зомеразе IV, тем фторхинолоны первого поколения.
Фторхинолоны связываются с ДНК с образованием сложного комплекса, в который входят 4 молекулы лекарственного вещества, молекула ДНК и ингибируемый фермент. В молекуле фторхинолонов можно выделить несколько участков, ответственных за связывание с ферментом-мишенью и проникновение в клетку:

В приведенной таблице показано влияние различных заместителей на антибактериальную активность фторхинолонов. Обязательными условиями для проявления антибактериальной активности являются атом азота в 1-м положении, карбоксильная группа в 3-м положении и оксогруппа в 4-м положении молекулы фторхинолона:
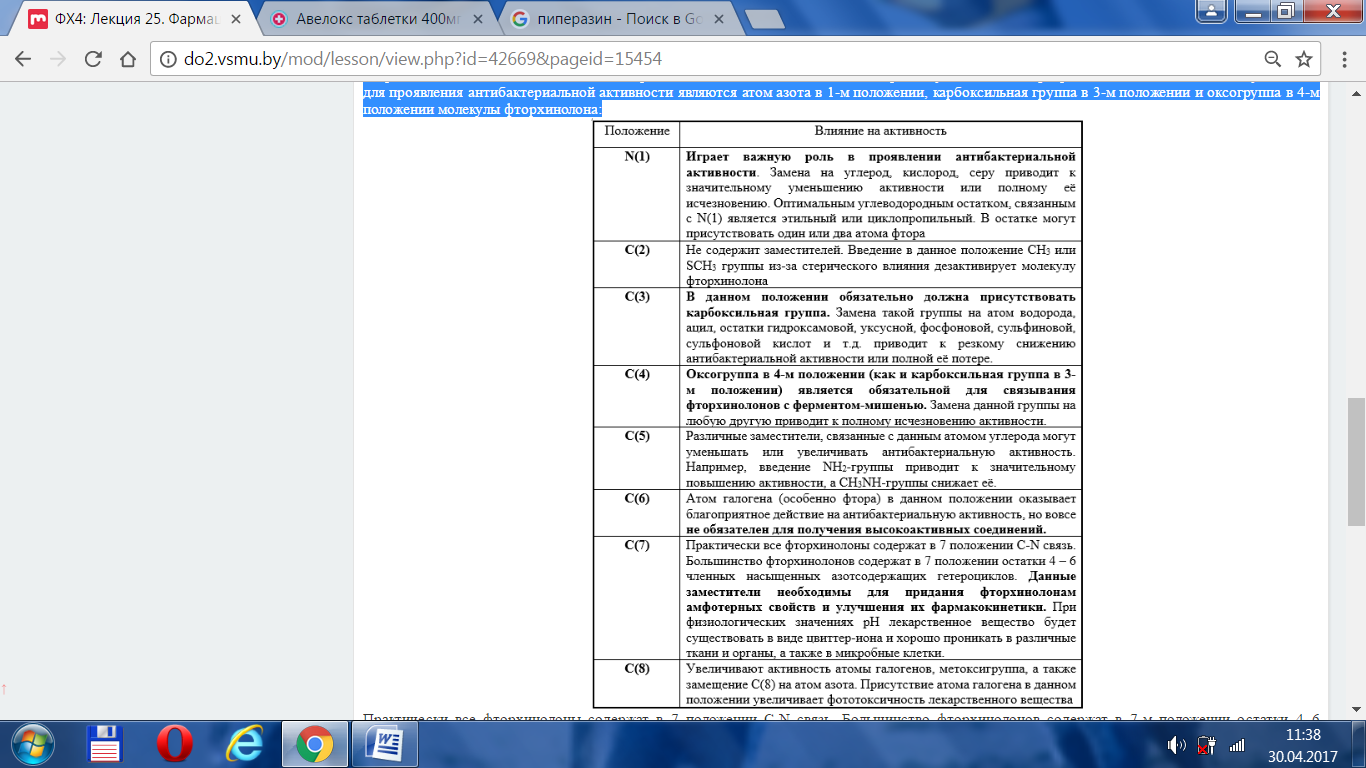
Практически все фторхинолоны содержат в 7 положении C-N связь. Большинство фторхинолонов содержат в 7-м положении остатки 4–6 членных насыщенных азотсодержащих гетероциклов. Данные заместители необходимы для придания фторхинолонам амфотерных свойств и улучшения их фармакокинетики. Заместитель специально подобран так, чтобы при физиологических значениях рН лекарственное вещество находилось в растворе в виде цвиттер-иона и хорошо проникало в различные ткани и органы, а также в микробные клетки.
Фторхинолоны являются амфолитами и могут находиться в водном растворе в виде катиона, цвиттер-иона, аниона или незаряженной молекулярной формы:
|
|
|
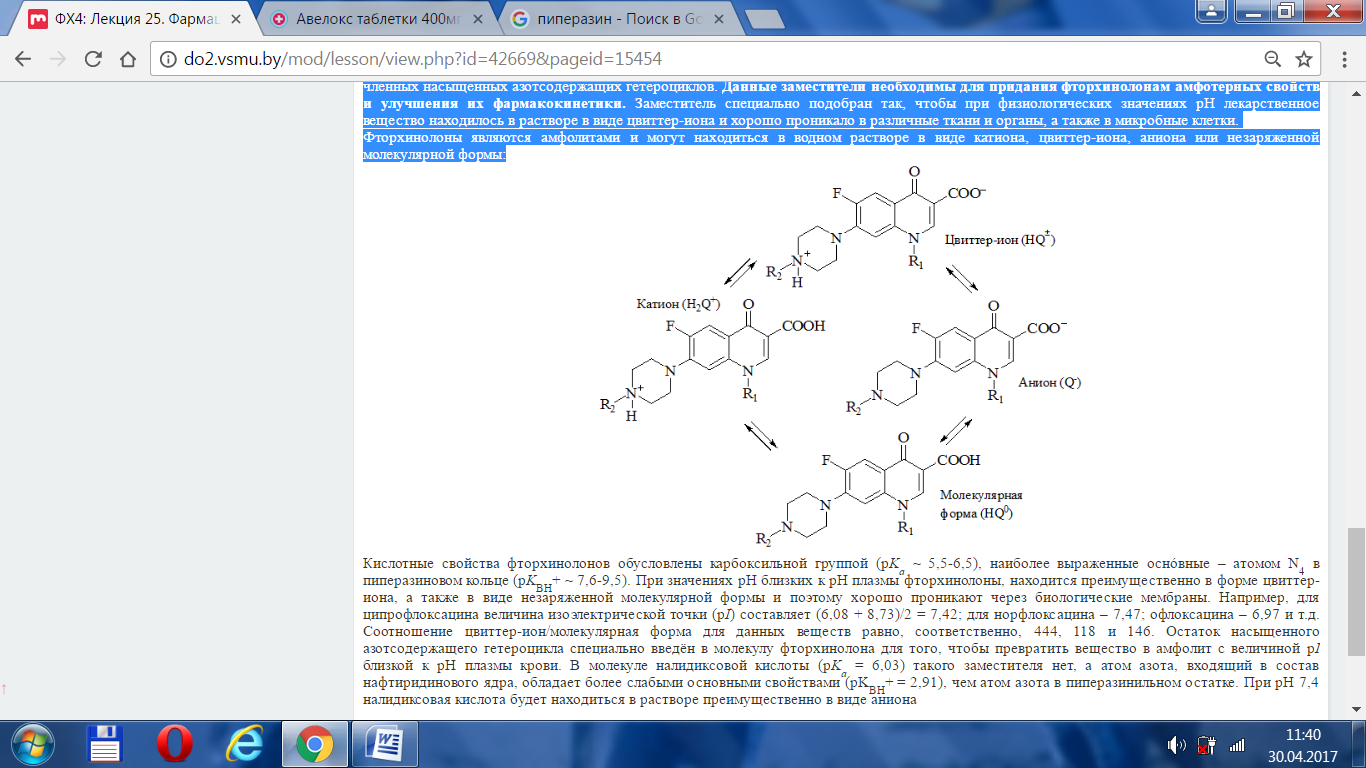
Кислотные свойства фторхинолонов обусловлены карбоксильной группой (p Ka ~ 5,5-6,5), наиболее выраженные оснóвные – атомом N4 в пиперазиновом кольце (p K BH+ ~ 7,6-9,5). При значениях рН близких к рН плазмы фторхинолоны, находится преимущественно в форме цвиттер-иона, а также в виде незаряженной молекулярной формы и поэтому хорошо проникают через биологические мембраны. Например, для ципрофлоксацина величина изоэлектрической точки (p I) составляет (6,08 + 8,73)/2 = 7,42; для норфлоксацина – 7,47; офлоксацина – 6,97 и т.д. Соотношение цвиттер-ион/молекулярная форма для данных веществ равно, соответственно, 444, 118 и 146. Остаток насыщенного азотсодержащего гетероцикла специально введён в молекулу фторхинолона для того, чтобы превратить вещество в амфолит с величиной p I близкой к рН плазмы крови. В молекуле налидиксовой кислоты (p Ka = 6,03) такого заместителя нет, а атом азота, входящий в состав нафтиридинового ядра, обладает более слабыми основными свойствами (pKBH+ = 2,91), чем атом азота в пиперазинильном остатке. При рН 7,4 налидиксовая кислота будет находиться в растворе преимущественно в виде аниона.
Программные фторхинолоны
1. Ципрофлоксацина гидрохлорид
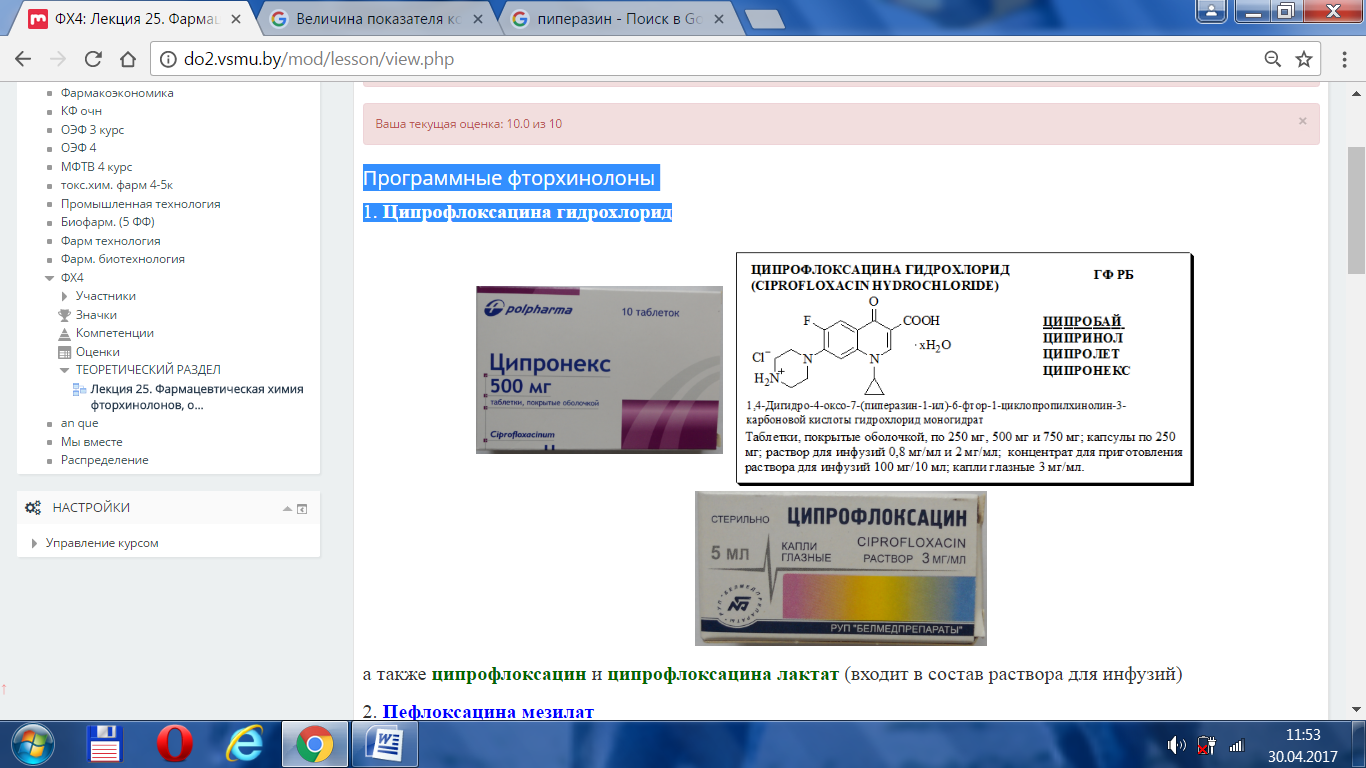
а также ципрофлоксацин и ципрофлоксацина лактат (входит в состав раствора для инфузий)
2. Пефлоксацина мезилат

3. Норфлоксацин

4. Офлоксацин

5. Левофлоксацин

6. Ломефлоксацина гидрохлорид

7. Моксифлоксацина гидрохлорид

Способы получения

Синтез на основе фторанилинов. 
Синтез на основе фторпроизводных бензойной кислоты. Используется, например, при получении ципрофлоксацина 
|
|
|


