 |
Произведение растворимости
|
|
|
|
Растворы электролитов
Растворение это самопроизвольный процесс диффузии молекул растворяемого вещества в растворитель и их равномерное распределение там.
При растворении происходит взаимодействие растворяемого вещества и растворителя, называемое, в общем случае, сольватацией. При использовании в качестве растворителя воды – гидратацией. Продукты взаимодействия при растворении называются, соответственно, сольватами или гидратами.
В ходе растворения протекают три стадии:
- молекулярная диссоциация,
- сольватация (образование сольватов молекул),
- электролитическая диссоциация.
Молекулярная диссоциация – это первая стадия растворения, связанная с необходимостью разрушения агрегатов (в случае твердого вещества) или ассоциатов молекул (в жидкостях).

 Пример: молекулы 100 % уксусной кислоты представляют собой ассоциаты, состоящие из двух частиц, связанных силами межмолекулярной водородной связи.
Пример: молекулы 100 % уксусной кислоты представляют собой ассоциаты, состоящие из двух частиц, связанных силами межмолекулярной водородной связи.

 СН3СООН · СН3СООН + Н2О ® СН3СООН + Н2О + СН3СООН
СН3СООН · СН3СООН + Н2О ® СН3СООН + Н2О + СН3СООН
Молекулярный ассоциат растворитель
Эта стадия требует затрат энергии, так как вода разрушает ассоциативную связь. Поэтому стадия сопровождается поглощением тепла (процесс эндотермический DН°¦ > 0). В зависимости от агрегатного состояния веществ, величины энтальпий образования меняются в следующем порядке DН°¦газ < DН°¦жид < DН°¦тв , так как на разрушение более прочных межмолекулярных связей требуется больше затрат энергии.
Образование сольватов – это вторая стадия растворения, в ходе которой образуется новый ассоциат между веществом и растворителем – сольват (гидрат). Поскольку этот процесс энергетически выгодный – он сопровождается выделением избытка тепла (экзотермический процесс, при котором DН°¦ < 0).
|
|
|
СН3СООН + nН2О ® СН3СООН · Н2О + (n – 1)Н2О
растворитель сольват (гидрат)
Многие процессы растворения заканчиваются на этой стадии, так как сольваты молекул достаточно прочны и произошло полное распределение частиц вещества между молекулами растворителя. Такие растворы называются растворами неэлектролитов. К их числу относят, чаще всего, растворы органических соединений, такие как водные растворы сахаров, эфиров, некоторых спиртов и т.п.
Значительная часть неорганических соединений подвергается третьей стадии растворения, которая называется электролитической диссоциацией. Это эндотермический процесс (DН°¦ > 0) разрушения сольватов с образованием ионов.
 СН3СООН · Н2О ® СН3СОО– + Н+ · Н2О
СН3СООН · Н2О ® СН3СОО– + Н+ · Н2О
Ацетат ион ¯
ион гидроксония [Н3О]+
Если процесс растворения протекает по трем ступеням, в ходе которых образуются ионы, полученный раствор называется раствором электролита.
Тепловой эффект процесса растворения складывается из тепловых эффектов всех стадий: DН°¦сольватации = åDН°¦i. При этом процесс растворения газов происходит, как правило, при понижении температуры, а твердых веществ – при повышении температуры.
Тепловой эффект растворения жидкости зависит от прочности межмолекулярных связей в ассоциатах.
Водные растворы электролитов – это системы, в которых вещества способны диссоциировать на ионы и, таким образом, проводить электрический ток. Все электролиты характеризуются степенью диссоциации (a), которая определяется отношением числа ионов, подвергшихся диссоциации, к общему числу растворенных молекул. Поскольку ионы образуются только в ходе реакции диссоциации, их количество можно назвать как количество прореагировавших частиц в единице объема DС, моль/л, а число растворенных молекул как Сисх, тогда a = DС / Сисх.
|
|
|
Если [C] – концентрация непродиссоциировавших частиц, установившаяся при равновесии (равновесная концентрация, моль/л), то между концентрациями существует зависимость
Сисх = [C] + DС,
откуда следует, что a = (Сисх – [C]) / Сисх.
Электролит будет называться сильным, если в ионы превратятся практически все растворенные молекулы ([C] = 0), а значит DС = Сисх, следовательно a» 1.
Электролит будет слабым, если количество ионов в растворе значительно меньше, чем число растворенных молекул. Принято считать слабыми электролитами такие, у которых a << 1 (~ 0,001). Реакция диссоциации слабого электролита – это равновесный процесс, поэтому все слабые электролиты принято характеризовать константой равновесия, которая для водных растворов разбавленных электролитов называется константой диссоциации (К Д). Значения констант диссоциации разбавленных водных растворов слабых кислот и оснований приводятся в справочниках химика (см. также, Приложение 1).
Пример: NH3 × H2О ® NH4+ + OH–
К Д = [NH4+] × [OH–] / [NH3 × H2О] = 1,8×10–5.
Некоторые сильные электролиты также характеризуются величинами констант диссоциации, но поскольку их диссоциация практически полностью смещена в сторону продуктов реакции, значения констант могут принимать очень большие значения. Пользуясь величинами констант диссоциации электролитов, можно оценить также силу электролита. Считается, что значения ~10–1 соответствуют электролитам средней силы, к ним относят, например, водные растворы H2SO3.
Сильные электролиты
Принято считать, что сильные электролиты существуют в растворах только в виде ионов, однако при распаде на ионы общее количество частиц в растворе резко возрастает, так как оно складывается из числа непродиссоциировавших ионов и общего числа ионов: [C] + n·DС = Сисх – a Сисх + n· a Сисх , где n – количество ионов.
Пример: НСI ® Н+ + СI–
для данной реакции a = 1, n = 2, следовательно общее число частиц определяется как Сисх – Сисх + 2Сисх = 2Сисх.
В трехионной молекуле общее число частиц будет равно 3Сисх, в четырехионной 4Сисх и т.д.
 Большое количество заряженных частиц в растворе создает условия для их взаимодействия, так как каждая из них может быть окружена большим количеством частиц другого заряда. В результате такого соседства между новыми ассоциатами, также могут возникнуть взаимодействия и, следовательно, образуются новые частицы. При определении свойств растворов, таких, как tкипения или tзамерзания, оказывается, что истинное значение концентрации электролита в растворе отличается от теоретического. Это значение было названо активностью ионов (a).
Большое количество заряженных частиц в растворе создает условия для их взаимодействия, так как каждая из них может быть окружена большим количеством частиц другого заряда. В результате такого соседства между новыми ассоциатами, также могут возникнуть взаимодействия и, следовательно, образуются новые частицы. При определении свойств растворов, таких, как tкипения или tзамерзания, оказывается, что истинное значение концентрации электролита в растворе отличается от теоретического. Это значение было названо активностью ионов (a).
|
|
|
Активность ионов сильного электролита пропорциональна моляльной концентрации растворенного вещества, а в сильноразбавленных растворах также и молярной концентрации (СМ), поскольку значения этих концентраций становятся близкими по значениям. Можно записать a ~ СМ или a = γ × CМ, где γ - коэффициент пропорциональности, зависящий от силы взаимодействия ионов в растворе сильного электролита, называемый коэффициентом активности.
Слабые электролиты
Степень диссоциации (a) слабого электролита много меньше единицы, поэтому в растворе устанавливается равновесие между ионами и молекулами растворенного вещества.
К слабым электролитам можно отнести некоторые кислоты: уксусную – СН3СООН, угольную – Н2СО3, сероводородную – Н2S, сернистую – Н2SO3, азотистую – HNO2, ортофосфорную – H3PO4 и др.; основания, образованные р- и d-элементами, а также гидроксид аммония и воду.
Так диссоциация уксусной кислоты соответствует уравнению: СН3СООН ↔ СН3СОО– + Н+.
Равновесные концентрации ее частиц можно записать в виде: [CН3СООН], [СН3СОО–], [Н+] и выразить их через величину a: [CН3СООН] = Сисх – a ×Сисх. [СН3СОО–] = [Н+] = a ×Сисх, то есть это доля прореагировавшего вещества DС.
Подставив эти значения в выражение для расчета константы равновесия или диссоциации, получим:
 ,
,  .
.
Если электролит очень слабый, то есть его константа диссоциации < 0,001, то отношение его исходной концентрации к величине константы Сисх / Кд будет больше либо равно 100, тогда величиной степени диссоциации в знаменателе можно пренебречь, и зависимость степени диссоциации от концентрации растворенного электролита примет вид  . Данное выражение носит название «Закон разбавления Оствальда»: При разбавлении раствора слабого электролита в 100 раз степень диссоциации возрастает в 10 раз.
. Данное выражение носит название «Закон разбавления Оствальда»: При разбавлении раствора слабого электролита в 100 раз степень диссоциации возрастает в 10 раз.
|
|
|
Если же отношение Сисх /Кд < 100, то есть электролит средней силы, то упростить выражение Кд = a 2 × Сисх / (1 – a) нельзя, а рассчитывать величину a необходимо по квадратному уравнению a 2×Сисх + Кд × a – К д = 0.
Учитывая вышеизложенные преобразования концентраций, можно вывести формулу зависимости концентрации ионов в растворе слабого электролита от исходной концентрации растворенного вещества: [СН3СОО–] = [Н+] = a ×Сисх, а
[CН3СООН] = Сисх – a ×Сисх = Сисх – [Н+], следовательно
Кд = [Н+]2 / (Сисх – [Н+]).
(Для слабого основания вместо концентрации ионов водорода в формуле будет стоять концентрация гидроксильных групп). Аналогично предыдущему случаю, если Сисх / К д > 100 (очень слабый электролит), выражение можно упростить, так как концентрация ионов водорода окажется малой по сравнению с единицей: Кд = [Н+]2 / Сисх, откуда 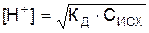 .
.
Для электролита средней силы, рассчитать концентрацию [Н+] можно по квадратному уравнению:
[Н+]2 + Кд × [Н+] – Кд × Сисх = 0.
6.2. Водородный показатель
Вода – слабый электролит, поскольку величина ее константы диссоциации составляет 1,8×10–16. Н2О = Н+ + ОН–
Кд = [Н+] × [ОН–] / [Н2О], где [Н2О] = соnst = 1000 / М18» 55,6 моль/1000 г. М18 – молярная масса воды г/моль. Откуда
Кд × [Н2О] = [Н+] × [ОН–] = 1,8×10–16× 55,6 = 10–14,
это произведение называется ионным произведением воды.
При отсутствии в воде посторонних примесей концентрация ионов водорода оказывается равной концентрации гидроксильных групп и составляет 10–7. Такая среда считается нейтральной.
Принято –lg[Н+] = рН – называть показателем кислотности среды, а –lg [ОН–] = рОН – называть показателем щелочности. В нейтральной среде оба показателя одинаковы:
рН = рОН = –lg (10–7) = 7.
Если в растворе [Н+] > [ОН–], то рН < 7 – среда считается кислой.
Если в растворе [Н+] < [ОН–], то рН > 7 – среда считается щелочной. Сумма этих показателей рН + рОН = 14.
Задания к разделам 6.1-6.2
| 1. | Вычислить [Н+] и рН растворов, если концентрацииионов ОН– равны (моль/л): 2,52·10–5; 1,78·10–7; 10–11. |
| 2. | Смешали равные объемы растворов сильных кислоты и щелочи с рН 2 и рН 12. Вычислить рН полученного раствора. |
| 3. | Найти значения рН и [Н+] в водных растворах, в которых концентрация ОН– - ионов (в моль/л) составляет: 1,2·10–4; 3,2·10–6; 7,4·10–11. |
| 4. | Во сколько раз концентрация ионов водородав крови(рН 7,36) больше, чем в спинномозговой жидкости (рН 7,53)? |
| 5. | Рассчитать [Н+] и рН конечного раствора, приготовленного смешиванием 0,3 л 0,1 М раствора НCl и 200 мл 0,2 М раствора NaOH с последующим разбавлением водой до 10 л. |
| 6. | Вычислить [Н+] и рН 0,005 %-го раствора HNO3. r раствора и a считать равными единице. |
| 7. | Как изменится концентрация [Н+] и ОН–, если рН раствора понизится с 8 до 5; увеличится от 3 до 9? |
| 8. | Найти СМ OH– - ионов в водных растворах, в которых концентрация ионов Н+ (в моль/л) равна: 10–3; 1,4·10–12. |
| 9. | Определить [Н+] и рН раствора, в 3 л которого содержится 0,76·10–3 молей [OH]-. |
| 10. | Вычислить рН раствора, полученного добавлением 0,8 л воды к 2,5 л азотной кислоты с рН 2. |
| 11. | Как изменится рН раствора после добавления к 300 мл 0,3 Н раствора Са(ОН)2 200 мл воды? |
| 12. | Вычислить [Н+] и рН растворов, если концентрацииионов ОН– равны (моль/л): 3,5·10–4; 2,8·10–7; 4,8·10–12. |
| 13. | Найти рН растворов и молярную концентрацию ионов [Н+] в водных растворах, в которых концентрация [OH]- (в моль/л) составляет: 3,2·10–3; 6,2·10–7; 8,4·10–12. |
| 14. | Смешали равные объемы растворов сильных кислоты и щелочи с рН 2 и рН 11. Вычислить рН полученного раствора. |
| 15. | Рассчитать рН и рОН конечного раствора, приготовленного смешиванием 0,1 л 0,3 М раствора НCl и 300 мл 0,4 М раствора NaOH с последующим разбавлением водой до 5 л. |
| 16. | Вычислить [Н+] и рН 0,01 %-го раствора HNO3. r раствора и a считать равными единице. |
| 17. | Как изменится концентрация Н+ и ОН–, если рН раствора понизится с 6,8 до 5,2; увеличится от 3,1 до 9,4? |
| 18. | Найти СМ ОН– в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: 1,4·10–4; 8,4·10–11. |
| 19. | Определить [Н+] и рН раствора, в 4 л которого содержится 7,6·10–3 моль [ОН–]. |
| 20. | Вычислить рН раствора, полученного добавлением 0,3 л воды к 0,5 л азотной кислоты с рН 3. |
| 21. | Как изменится рН раствора после добавления к 200 мл 0,04 Н раствора Ва(ОН)2 200 мл воды? |
| 22. | Вычислить [Н+] и рН растворов, если концентрацииионов ОН– равны (моль/л): 3,5·10–2; 6,7·10–6; 6,6·10–11. |
| 23. | Смешали равные объемы растворов сильной кислоты и щелочи с рН 1 и рН 10. Вычислить [Н+] и рН полученного раствора. |
| 24. | Найти рН растворов и СМ ионов [Н+] в водных растворах, в которых концентрация ОН– (в моль/л) составляет: 2·10–2; 3,8·10–7; 2,9·10–13. |
| 25. | Рассчитать [Н+] и рН конечного раствора, приготовленного смешиванием 0,4 л 0,1 М раствора Н2SO4 и 100 мл 0,4 М раствора NaOH с последующим разбавлением водой до объема 1 л. |
| 26. | Вычислить [Н+] и рН 0,05 %-го раствора Н2SO4. r раствора и a считать равными единице. |
| 27. | Как изменится концентрация ионов водорода и ОН–, если рН раствора понизится с 9 до 4; увеличится от 2 до 8? |
| 28. | Найти СМ ОН– в водных растворах, в которых концентрация ионов водорода (в моль/л) равна: 3,4·10–4; 5,4·10–10. |
| 29. | Определить [Н+] и рН раствора, в 1,3 л которого содержится 5,6·10–3 моль ОН–. |
| 30. | Вычислить рН раствора, полученного добавлением 0,5 л воды к 1,5 л азотной кислоты с рН 2. |
| 31. | Как изменится рН раствора после добавления к 300 мл 0,3 Н раствора КОН 200 мл воды? |
| 32. | Вычислить рН раствора, полученного растворением 54,3 мл 98 %-го раствора H2SO4 (r = 1,84 г/см3) в 5 л воды. Диссоциацию кислоты в растворе считать полной, а r полученного раствора равной 1 г/см3. |
| 33. | Как изменится концентрация Н+, если рН раствора понизится с 9 до 6; увеличится от 4 до 8? |
| 34. | Вычислить СМ и СН раствора серной кислоты, если известно, что рН 2,2. |
| 35. | Рассчитать рН конечного раствора, приготовленного смешиванием 200 мл 0,1М раствора НCl и 100 мл 0,2М раствора NaOH с последующим разбавлением водой до 10 л. |
| 36. | Вычислить [Н+] и рН растворов, если концентрацииионов ОН– равны (моль/л): 2,1·10–3; 1,2·10–7; 1,8·10–11. |
| 37. | Смешали равные объемы растворов сильных кислоты и щелочи с рН 4 и рН 10. Вычислить [Н+], рН и рОН полученного раствора. |
| 38. | Рассчитать [Н+] и рН конечного раствора, приготовленного смешиванием 0,3 л 0,1 Н раствора H2SO4 и 200 мл 0,2 Н раствора Са(ОН)2 с последующим разбавлением водой до 10 л. |
| 39. | Вычислить [Н+] и рН 0,005 %-го раствора HNO3, r раствора и a считать равными единице. |
| 40. | Как изменится концентрация ионов водорода и ОН–, если рН раствора понизится с 8 до 5; увеличится от 3 до 9? |
| 41. | Вычислить рН раствора, полученного добавлением 0,1 л воды к 0,5 л азотной кислоты с рН 3. |
| 42. | Как изменится рН раствора после добавления к 400 мл 0,4 Н раствора Са(ОН)2 400 мл воды? |
Произведение растворимости
|
|
|
Понятие произведения растворимости связано с процессами растворения малорастворимых веществ, растворимость, а следовательно и концентрация которых в растворе чрезвычайно мала, менее 10–2 моль/л. Подобные растворы, как правило, насыщенные, то есть процесс растворение ↔кристаллизация является равновесным и обратимым.
Пример: Добавление избытка кристаллического сульфата бария в раствор не увеличит количество ионов. Кроме того, изменение термодинамических условий (охлаждение), наоборот, может привести к смещению равновесия влево, то есть к осаждению кристаллов сульфата бария. ВаSО4 (Т) ↔ Ва2+(Р) + SО42–(Р).
Это означает, что малорастворимое вещество может перейти в раствор только в виде ионов и не существует в растворе в виде молекул. Константа равновесия для такого процесса будет определяться только концентрацией растворенной фазы и не зависит от концентрации твердого вещества.
К Р = [Ва2+]×[SO42–] = соnst = ПР.
Константа равновесия, характеризующая растворение малорастворимого соединения называется произведением растворимости. Величина произведения растворимости это постоянная величина для данного малорастворимого соединения в его насыщенном растворе при заданной температуре (Приложение 3).
Поскольку в растворе присутствуют только ионы, то растворы малорастворимых солей называют сильными электролитами, а их концентрацию определяют по величине активности ионов (а).
Пример: ПР = a Ва2+ × a SO42–.
Этим правилом можно пренебречь лишь в случае, когда ионная сила в растворе менее, чем 0,001, и лишь при отсутствии в растворе других посторонних ионов.
Зная величину ПР, можно определить растворимость S (в моль/л) данной малорастворимой соли в растворе. Растворимостью называют предельную концентрацию вещества в составе растворителя, которая может раствориться при данных термодинамических условиях (обычно в справочных пособиях в г/100 г растворителя, в задачах моль/л).
Растворимость зависит от числа ионов, на которые распадается вещество при диссоциации.
 ↔mMen+ + nAm–, a Men+ = [Men+] = m×S; a Am– = [Am–] = nS,
↔mMen+ + nAm–, a Men+ = [Men+] = m×S; a Am– = [Am–] = nS,
Таким образом, величину ПР можно записать как
ПР = (m S)n × (n S)m.
Следовательно:
1) для двухионного вещества: AlPO4, ПР = S × S = S2.
2) для трехионного вещества: СаF2, ПР = S × (2S)2 = 4S3.
3) для четырехионного вещества: Ag3PO4, ПР = (3S)3 × S = 27S4.
4) для пятиионного вещества: Са3(РО4)2, ПР = (3S)3× (2S)2 = 108S5.
Наоборот, зная величину растворимости, можно вычислить ПР.
Добавка в растворы малорастворимых солей других видов ионов, влияет на ионную силу раствора, поэтому растворимость такого соединения изменится, поскольку изменится их активность (концентрация). Существуют условия, при которых наблюдается выпадение осадков малорастворимых солей из растворов:
1) если ПР > [Men+]m × [Am–]n – осадка не образуется,
2) если ПР < [Men+]m × [Am–]n – осадок выпадет,
3) если ПР = [Men+]m × [Am–]n – раствор насыщенный.
Задания к разделу 6.3
Вычислить растворимость (моль/л):
| 1. | иодида меди(I) | ортофосфата висмута |
| 2. | карбоната кальция | ортофосфата железа(III) |
| 3. | бромида серебра | сульфита кальция |
| 4. | ацетата серебра: | сульфата кальция |
| 5. | хлорида серебра | оксалата кадмия |
| 6. | хлорита серебра | карбоната кобальта |
| 7. | хлората серебра | карбоната марганца |
| 8. | нитрата серебра | сульфида олова(II) |
| 9. | оксалата бария | ортофосфата алюминия |
| 10. | сульфита бария | сульфида серебра |
| 11. | сульфата бария | роданида серебра |
| 12. | карбоната бария | хромата бария |
| 13. | карбоната бериллия | карбоната бария |
| 14. | сульфида железа (II) | манганата бария |
| 15. | йодата серебра | оксалата свинца |
| 16. | сульфида кобальта | сульфида меди(II) |
| 17. | сульфида кадмия | хлорида ртути (I) |
| 18. | ортоарсената висмута | сульфида цинка |
| 19. | карбоната кадмия | сульфида висмута |
| 20. | оксалата кальция | иодида висмута |
| 21. | оксалата меди | сульфида серебра |
| 22. | карбоната железа (II) | ортофосфата цинка |
| 23. | ортофосфата цезия | ортоарсената цинка |
| 24. | сульфида сурьмы | ортофосфата бария |
| 25. | нитрата бария | ортофосфата никеля(II) |
| 26. | хлорида свинца(II) | фторида бария |
| 27. | роданида свинца(II) | ортоарсената бария |
| 28. | сульфата серебра | ортоарсената свинца(II |
| 29. | бромида свинца(II) | сульфита серебра |
| 30. | ортофосфата магния | ортофосфата серебра |
| 31. | ортоарсената магния | хромата серебра |
| 32. | дихромата серебра | ортоарсената кобальта |
| 33. | ортофосфата кальция | йодата бария |
| 34. | ортоарсената кальция | йодата кальция |
| 35. | оксалата серебра | йодата меди(II) |
| 36. | карбоната серебра | йодата никеля(II) |
| 37. | ортоарсената серебра | йодида свинца(II) |
| 38. | ортоарсената цинка | ортофосфата стронция |
| 39. | бромата бария | фторида свинца(II). |
| 40. | фторида стронция | дифосфата бария |
| 41. | йодида олова(II) | сульфида висмута |
| 42. | фторида кальция | фторида магния |

|
|
|


