 |
Горючее – сложное вещество с известным элементным составом
|
|
|
|
Состав таких веществ выражается в массовых долях (w, %) каждого элемента. При горении кислород воздуха расходуется на окисление углерода С, водорода Н, серы S и других горючих составляющих.
Рассчитаем, какой теоретический объем воздуха необходим для сгорания 1 кг каждого элемента при нормальных условиях.
1 кг х м3
С + (О2 + 3,76N2) = СО2 + 3,76N2
12 кг 4,76×22,4 м3
Vв(С)теор = х =  = 8,885 м3 – объем воздуха для сгорания 1 кг углерода.
= 8,885 м3 – объем воздуха для сгорания 1 кг углерода.
1 кг х м3
Н + 0,25(О2 + 3,76N2) = 0,5Н2О + 0,25×3,76N2
1 кг 0,25×4,76×22,4 м3
Vв(Н)теор = х = 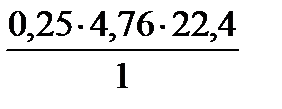 = 26,656 м3 – объем воздуха для сгорания 1 кг водорода.
= 26,656 м3 – объем воздуха для сгорания 1 кг водорода.
1 кг х м3
S + (О2 + 3,76N2) = SО2 + 3,76N2
32 кг 4,76×22,4 м3
Vв(S)теор = х = 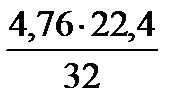 = 3,332 м3 – объем воздуха для сгорания 1 кг серы.
= 3,332 м3 – объем воздуха для сгорания 1 кг серы.
Углерод, водород и сера являются основными составляющими большинства органических соединений. Значительное число органических веществ имеют в своем составе кислород, и, следовательно, воздуха на горение будет затрачено меньше.
Рассчитаем объем воздуха, в котором содержится 1 кг кислорода.
32 кг О2 - 4,76×22,4 м3 воздуха
1 кг - х м3
Vв(О)теор = х = 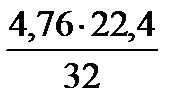 = 3,332 м3 – объем воздуха, содержащий 1 кг кислорода.
= 3,332 м3 – объем воздуха, содержащий 1 кг кислорода.
Сопоставим полученные значения.
Vв(Н)теор: Vв(С)теор: Vв(S)теор:Vв(О)теор =
= 26,665: 8,885: 3,332: 3,332 = 1: 1/3: 1/8: 1/8
Теоретическое количество воздуха для сгорания 1 кг вещества сложного элементного состава в общем виде можно записать следующим образом:
Vвтеор = Vв(С)теор × 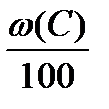 + Vв(Н)теор ×
+ Vв(Н)теор ×  + Vв(S)теор ×
+ Vв(S)теор × 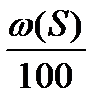 - Vв(О)теор ×
- Vв(О)теор × 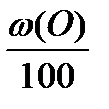 , м3 (2.7)
, м3 (2.7)
где
w (С), w (Н), w (S), w (О) – массовые доли элементов в веществе, %.
После подстановки в формулу (2.7) полученных выше расчетных значений теоретический объем воздуха для сгорания заданной массы (m)вещества сложного элементного состава при нормальных условиях определяется по формуле:
|
|
|
Vвтеор =m × 0,267  , м3/кг. (2.8)
, м3/кг. (2.8)
| Расчет объема воздуха, необходимого для горения вещества сложного элементного состава | Пример 2.7. Определить объем воздуха, необходимого для полного сгорания 5 кг торфа следующего состава (в %): С – 56,4 %, Н – 5,04 %, О – 24,0 %, S – 0,06 %, N – 3,6 %, зола – 10,9 %. Горение протекает при a = 1,5, условия нормальные. |
1. По формуле (3.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца торфа:
Vвтеор = 5 × 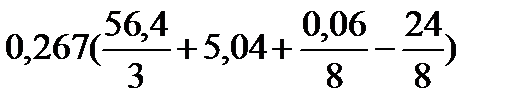 = 27,7 м3
= 27,7 м3
2. С учетом коэффициента избытка воздуха реально на сгорание данной массы образца торфа будет затрачено воздуха
Vвпр = Vвтеор × a = 27,7 × 1,5 = 41,6 м3.
Расчет объема и процентного состава продуктов горения
Состав продуктов горения зависит от химической природы горючего материала и условий его горения. Практически всегда органические вещества горят с образованием продуктов полного и неполного горения.
К продуктам полного сгорания относятся: углекислый газ, образующийся при горении углерода, разложении карбонатов; водяной пар, образующийся при горении водорода и испарении влаги в исходном веществе; оксид серы (IV) SO2 и азот – продукты горения соединений, содержащих серу и азот.
Продукты неполного сгорания – это оксид углерода (II) – угарный газ СО, сажа С, продукты термоокислительного разложения – смолы.
Неорганические вещества сгорают, как правило, до соответствующих оксидов.
Выход продуктов горения количественно установить невозможно из-за чрезвычайной сложности их состава, поэтому материальный баланс процесса горения рассчитывается из предположения, что вещество сгорает полностью до конечных продуктов. При этом в состав продуктов горения включают также азот воздуха, израсходованного на горение, и избыток воздуха при a > 1.
Как и в случае расчета объема воздуха, необходимого для горения, свои особенности имеет расчет продуктов горения для индивидуальных веществ, смеси газов и веществ с известным элементным составом.
|
|
|
|
|
|


