 |
Стандартизация 0.1 М раствора соляной кислоты
|
|
|
|
Приготовление из концентрированного раствора.
В лаборатории используется титрованный раствор для особо точных и ответственных анализов. Его можно приготовить из более концентрированного раствора, а титр установить по какому-либо стандартному веществу. Для разбавления используют обычно соляную кислоту марки «х.ч.» или «ч.д.а.» которая имеется в продаже. Предварительно с помощью ареометра измеряют плотность реактива и по специальным таблицам, которые приведены во многих справочниках, определяют ее концентрацию и рассчитывают количество раствора, необходимого для разбавления. В ряде таблиц приводится зависимость плотности раствора кислоты не только от массовой доли, но и от ее молярной концентрации – С0. В этом случае количество концентрированного раствора кислоты – V0, необходимое для приготовления разбавленного, легко вычислить по отношению:
V0 = 
где V – объем разбавленного раствора кислоты, который необходимо приготовить, см3; С – его концентрация, моль/дм3; С0 – концентрация исходного раствора кислоты, моль/дм3
В нашей работе:
Измерив плотность раствора ƿ (HCl) = 1.161, по таблице находим соответствующее ей значение массовой доли w(HCl) = 32.344. Vр-ра = 300мл, С=0.1 М
Теперь можно вычислить количество концентрированного раствора кислоты:
V0 = 
М(HCl)=36.45
V0 (HCl) = 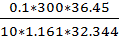 = 2.916 мл
= 2.916 мл
Экспериментальная часть
В мерную колбу вместимостью 1000 см3 наливаю примерно наполовину дистиллированной воды, с помощью градуированной пипетки отмериваю рассчитанный объем концентрированной кислоты и вливаю его в колбу. Затем колбу доливаю водой до метки и перемешиваю.
Стандартизация 0.1 М раствора соляной кислоты
Раствор кислоты, приготовленный разбавлением концентрированного раствора, необходимо стандартизировать, т.е. определить его точную концентрацию. Одним из лучших и наиболее распространенных стандартов является декагидрат тетрабората натрия Na2B4O7*10H2O (бура). Бура при растворении в воде подвергается гидролизу:
|
|
|
B4O7 + 3H2O <=> 2H3BO3 + 2BO2
и метаборат – ион затем реагирует с кислотой:
BO2 + H+ + H2O <=> H3BO3
или в молекулярной формуле:
Na2B4O7 + 2HCl + 5 H2O <=> 4H3BO3 + 2NaCl.
Таким образом, на титрование 1 моля тетрабората натрия расходуется 2 моля ионов H+, следовательно, фактор эквивалентности равен fэкв = ½, а молярная масса эквивалента буры равна:
M(1/2 Na2B4O7*10H2O) = 1/2M(Na2B4O7*10H2O) =  = 190.71
= 190.71
При титровании буры образуется слабая кислота, поэтому подходящим индикатором в этом случае является метиловый оранжевый, который изменяет свою окраску от желтой к оранжевой.
Для стандартизации раствора применим метод пипетирования.
При стандартизации растворов этим методом готовят раствор стандартного вещества по его точной навеске с концентрацией, обычно, близкой к концентрации устанавливаемого раствора. Затем отбирают аликвоту раствора стандартного вещества и титруют ее приготовленным раствором кислоты.
Расчет навески буры:
V(HCl)=250 мл, C(HCl)=0.1 М
qбуры=  * Mэкв. буры =
* Mэкв. буры =  *190.71 = 4.76775 г
*190.71 = 4.76775 г
qбуры + 10% = 5.24452 г
qбуры – 10% = 4.29097 г
Экспериментальная часть
1) Взвешиваю сухой весовой стаканчик (бюкс)
2) Насыпаю буру и снова взвешиваю, по разности нахожу массу буры – m2-m1=4.106г
3) Навеску буры количественно переношу через воронку в мерную колбу, обмываю стенки стаканчика струей дистиллированной воды из промывалки, сливая ее в колбу, обмываю воронку и вынимаю ее из горлышка колбы.
4) Перемешиваю содержимое колбы вращательным движением до полного растворения всех кристаллов, после этого доливаю колбу до метки дистиллированной водой, закрываю пробкой и тщательно перемешиваю.
5)Чистую пипетку вместимостью 20 мл ополаскиваю небольшим количеством приготовленного раствора, набираю раствор и переношу в чистую колбу для титрования.
|
|
|
6) В колбу приливаю 80мл дистиллированной воды.
7) Ввожу 3 капли индикатора метилоранжа и титрую приготовленным раствором кислоты до перехода окраски из желтой в оранжевую.
Повторяю пункты 5, 6, 7 еще 2 раза.
При первом титровании Vпипетки=20,7 мл
При втором титровании Vпипетки= 20,7 мл
При третьем титровании Vпипетки= 20,7 мл
Все три результата совпадают, поэтому среднее значение Vср=20,7 мл
Рассчитываем молярную концентрацию соляной кислоты:
С(HCl) =  *
* 
где g – масса навески буры, г; Vколбы – объем мерной колбы, в которой растворяется навеска буры, мл; Vпипетки – объем аликвоты раствора буры, взятой для титрования, мл; V – объем раствора HCl, израсходованный на титрование аликвоты раствора буры, мл; M(1/2 Na2B4O7*10H2O) – молярная масса эквивалента буры, г/моль.
С(HCl)=  *
*  =0.083 моль/л
=0.083 моль/л
Министерство образования Российской Федерации
Ивановский государственный энергетический университет
|
|
|


